+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
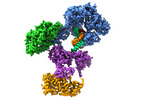
| タイトル | Cryo-EM structure of S. cerevisiae DNA polymerase alpha-primase complex in the DNA elongation state | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | DNA polymerase / primase / DNA replication / DNA BINDING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報alpha DNA polymerase:primase complex / : / DNA replication, synthesis of primer / lagging strand elongation / mitotic DNA replication initiation / leading strand elongation / DNA replication origin binding / DNA replication initiation / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / single-stranded DNA binding ...alpha DNA polymerase:primase complex / : / DNA replication, synthesis of primer / lagging strand elongation / mitotic DNA replication initiation / leading strand elongation / DNA replication origin binding / DNA replication initiation / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / single-stranded DNA binding / 4 iron, 4 sulfur cluster binding / DNA-directed DNA polymerase / DNA-directed DNA polymerase activity / nucleotide binding / chromatin binding / DNA binding / metal ion binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.56 Å | ||||||||||||
 データ登録者 データ登録者 | Yuan Z / Georgescu R / Li H / O'Donnell M | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 | ジャーナル: bioRxiv / 年: 2023 タイトル: Molecular choreography of primer synthesis by the eukaryotic Pol α-primase. 著者: Zuanning Yuan / Roxana Georgescu / Huilin Li / Michael E O'Donnell /  要旨: The eukaryotic polymerase α (Pol α) is a dual-function DNA polymerase/primase complex that synthesizes an RNA-DNA hybrid primer of 20-30 nucleotides for DNA replication. Pol α is composed of Pol1, ...The eukaryotic polymerase α (Pol α) is a dual-function DNA polymerase/primase complex that synthesizes an RNA-DNA hybrid primer of 20-30 nucleotides for DNA replication. Pol α is composed of Pol1, Pol12, Primase 1 (Pri1), and Pri2, with Pol1 and Pri1 containing the DNA polymerase activity and RNA primase activity, respectively, whereas Pol12 and Pri2 serve a structural role. It has been unclear how Pol α hands over an RNA primer made by Pri1 to Pol1 for DNA primer extension, and how the primer length is defined, perhaps due to the difficulty in studying the highly mobile structure. Here we report a comprehensive cryo-EM analysis of the intact 4-subunit yeast Pol α in the apo, primer initiation, primer elongation, RNA primer hand-off from Pri1 to Pol1, and DNA extension states in a 3.5 Å - 5.6 Å resolution range. We found that Pol α is a three-lobed flexible structure. Pri2 functions as a flexible hinge that holds together the catalytic Pol1-core, and the noncatalytic Pol1 CTD that binds to Pol 12 to form a stable platform upon which the other components are organized. In the apo state, Pol1-core is sequestered on the Pol12-Pol1-CTD platform, and Pri1 is mobile perhaps in search of a template. Upon binding a ssDNA template, a large conformation change is induced that enables Pri1 to perform RNA synthesis, and positions Pol1-core to accept the future RNA primed site 50 Å upstream of where Pri1 binds. We reveal in detail the critical point at which Pol1-core takes over the 3'-end of the RNA from Pri1. DNA primer extension appears limited by the spiral motion of Pol1-core while Pri2-CTD stably holds onto the 5' end of the RNA primer. Since both Pri1 and Pol1-core are attached via two linkers to the platform, primer growth will produce stress within this "two-point" attachment that may limit the length of the RNA-DNA hybrid primer. Hence, this study reveals the large and dynamic series of movements that Pol α undergoes to synthesize a primer for DNA replication. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29352.map.gz emd_29352.map.gz | 7.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29352-v30.xml emd-29352-v30.xml emd-29352.xml emd-29352.xml | 24.4 KB 24.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_29352.png emd_29352.png | 79 KB | ||
| Filedesc metadata |  emd-29352.cif.gz emd-29352.cif.gz | 7.9 KB | ||
| その他 |  emd_29352_half_map_1.map.gz emd_29352_half_map_1.map.gz emd_29352_half_map_2.map.gz emd_29352_half_map_2.map.gz | 49.7 MB 49.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29352 http://ftp.pdbj.org/pub/emdb/structures/EMD-29352 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29352 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29352 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29352_validation.pdf.gz emd_29352_validation.pdf.gz | 687.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29352_full_validation.pdf.gz emd_29352_full_validation.pdf.gz | 686.8 KB | 表示 | |
| XML形式データ |  emd_29352_validation.xml.gz emd_29352_validation.xml.gz | 12.1 KB | 表示 | |
| CIF形式データ |  emd_29352_validation.cif.gz emd_29352_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29352 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29352 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29352 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29352 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29352.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29352.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.828 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
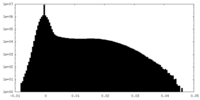
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_29352_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
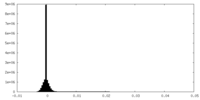
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_29352_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
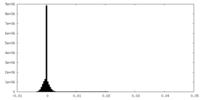
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : DNA polymerase alpha/primase complex
| 全体 | 名称: DNA polymerase alpha/primase complex |
|---|---|
| 要素 |
|
-超分子 #1: DNA polymerase alpha/primase complex
| 超分子 | 名称: DNA polymerase alpha/primase complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#6 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: DNA polymerase
| 分子 | 名称: DNA polymerase / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 167.027766 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSSKSEKLEK LRKLQAARNG TSIDDYEGDE SDGDRIYDEI DEKEYRARKR QELLHDDFVV DDDGVGYVDR GVEEDWREVD NSSSDEDTG NLASKDSKRK KNIKREKDHQ ITDMLRTQHS KSTLLAHAKK SQKKSIPIDN FDDILGEFES GEVEKPNILL P SKLRENLN ...文字列: MSSKSEKLEK LRKLQAARNG TSIDDYEGDE SDGDRIYDEI DEKEYRARKR QELLHDDFVV DDDGVGYVDR GVEEDWREVD NSSSDEDTG NLASKDSKRK KNIKREKDHQ ITDMLRTQHS KSTLLAHAKK SQKKSIPIDN FDDILGEFES GEVEKPNILL P SKLRENLN SSPTSEFKSS IKRVNGNDES SHDAGISKKV KIDPDSSTDK YLEIESSPLK LQSRKLRYAN DVQDLLDDVE NS PVVATKR QNVLQDTLLA NPPSAQSLAD EEDDEDSDED IILKRRTMRS VTTTRRVNID SRSNPSTSPF VTAPGTPIGI KGL TPSKSL QSNTDVATLA VNVKKEDVVD PETDTFQMFW LDYCEVNNTL ILFGKVKLKD DNCVSAMVQI NGLCRELFFL PREG KTPTD IHEEIIPLLM DKYGLDNIRA KPQKMKYSFE LPDIPSESDY LKVLLPYQTP KSSRDTIPSD LSSDTFYHVF GGNSN IFES FVIQNRIMGP CWLDIKGADF NSIRNASHCA VEVSVDKPQN ITPTTTKTMP NLRCLSLSIQ TLMNPKENKQ EIVSIT LSA YRNISLDSPI PENIKPDDLC TLVRPPQSTS FPLGLAALAK QKLPGRVRLF NNEKAMLSCF CAMLKVEDPD VIIGHRL QN VYLDVLAHRM HDLNIPTFSS IGRRLRRTWP EKFGRGNSNM NHFFISDICS GRLICDIANE MGQSLTPKCQ SWDLSEMY Q VTCEKEHKPL DIDYQNPQYQ NDVNSMTMAL QENITNCMIS AEVSYRIQLL TLTKQLTNLA GNAWAQTLGG TRAGRNEYI LLHEFSRNGF IVPDKEGNRS RAQKQRQNEE NADAPVNSKK AKYQGGLVFE PEKGLHKNYV LVMDFNSLYP SIIQEFNICF TTVDRNKED IDELPSVPPS EVDQGVLPRL LANLVDRRRE VKKVMKTETD PHKRVQCDIR QQALKLTANS MYGCLGYVNS R FYAKPLAM LVTNKGREIL MNTRQLAESM NLLVVYGDTD SVMIDTGCDN YADAIKIGLG FKRLVNERYR LLEIDIDNVF KK LLLHAKK KYAALTVNLD KNGNGTTVLE VKGLDMKRRE FCPLSRDVSI HVLNTILSDK DPEEALQEVY DYLEDIRIKV ETN NIRIDK YKINMKLSKD PKAYPGGKNM PAVQVALRMR KAGRVVKAGS VITFVITKQD EIDNAADTPA LSVAERAHAL NEVM IKSNN LIPDPQYYLE KQIFAPVERL LERIDSFNVV RLSEALGLDS KKYFRREGGN NNGEDINNLQ PLETTITDVE RFKDT VTLE LSCPSCDKRF PFGGIVSSNY YRVSYNGLQC KHCEQLFTPL QLTSQIEHSI RAHISLYYAG WLQCDDSTCG IVTRQV SVF GKRCLNDGCT GVMRYKYSDK QLYNQLLYFD SLFDCEKNKK QELKPIYLPD DLDYPKEQLT ESSIKALTEQ NRELMET GR SVVQKYLNDC GRRYVDMTSI FDFMLN UniProtKB: DNA polymerase |
-分子 #2: DNA primase
| 分子 | 名称: DNA primase / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 47.760367 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTNSVKTNGP SSSDMEYYYK SLYPFKHIFN WLNHSPKPSR DMINREFAMA FRSGAYKRYN SFNSVQDFKA QIEKANPDRF EIGAIYNKP PRERDTLLKS ELKALEKELV FDIDMDDYDA FRTCCSGAQV CSKCWKFISL AMKITNTALR EDFGYKDFIW V FSGRRGAH ...文字列: MTNSVKTNGP SSSDMEYYYK SLYPFKHIFN WLNHSPKPSR DMINREFAMA FRSGAYKRYN SFNSVQDFKA QIEKANPDRF EIGAIYNKP PRERDTLLKS ELKALEKELV FDIDMDDYDA FRTCCSGAQV CSKCWKFISL AMKITNTALR EDFGYKDFIW V FSGRRGAH CWVSDKRARA LTDVQRRNVL DYVNVIRDRN TDKRLALKRP YHPHLARSLE QLKPFFVSIM LEEQNPWEDD QH AIQTLLP ALYDKQLIDS LKKYWLDNPR RSSKEKWNDI DQIATSLFKG PKQDSHIIKL RECKEDLVLM TLYPKLDVEV TKQ TIHLLK APFCIHPATG NVCVPIDESF APEKAPKLID LQTEMEKNND VSLTALQPFI NQFQAYVSSL LKNELGSVKR ERED DDEPA SLDF UniProtKB: DNA primase |
-分子 #3: DNA primase large subunit
| 分子 | 名称: DNA primase large subunit / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 62.348551 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MFRQSKRRIA SRKNFSSYDD IVKSELDVGN TNAANQIILS SSSSEEEKKL YARLYESKLS FYDLPPQGEI TLEQFEIWAI DRLKILLEI ESCLSRNKSI KEIETIIKPQ FQKLLPFNTE SLEDRKKDYY SHFILRLCFC RSKELREKFV RAETFLFKIR F NMLTSTDQ ...文字列: MFRQSKRRIA SRKNFSSYDD IVKSELDVGN TNAANQIILS SSSSEEEKKL YARLYESKLS FYDLPPQGEI TLEQFEIWAI DRLKILLEI ESCLSRNKSI KEIETIIKPQ FQKLLPFNTE SLEDRKKDYY SHFILRLCFC RSKELREKFV RAETFLFKIR F NMLTSTDQ TKFVQSLDLP LLQFISNEEK AELSHQLYQT VSASLQFQLN LNEEHQRKQY FQQEKFIKLP FENVIELVGN RL VFLKDGY AYLPQFQQLN LLSNEFASKL NQELIKTYQY LPRLNEDDRL LPILNHLSSG YTIADFNQQK ANQFSENVDD EIN AQSVWS EEISSNYPLC IKNLMEGLKK NHHLRYYGRQ QLSLFLKGIG LSADEALKFW SEAFTRNGNM TMEKFNKEYR YSFR HNYGL EGNRINYKPW DCHTILSKPR PGRGDYHGCP FRDWSHERLS AELRSMKLTQ AQIISVLDSC QKGEYTIACT KVFEM THNS ASADLEIGEQ THIAHPNLYF ERSRQLQKKQ QKLEKEKLFN NGNH UniProtKB: DNA primase large subunit |
-分子 #4: DNA polymerase alpha subunit B
| 分子 | 名称: DNA polymerase alpha subunit B / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 78.865938 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSGSIDVITH FGPDADKPEI ITALENLTKL HALSVEDLYI KWEQFSNQRR QTHTDLTSKN IDEFKQFLQL QMEKRANQIS SSSKVNTST KKPVIKKSLN SSPLFGLSIP KTPTLKKRKL HGPFSLSDSK QTYNVGSEAE TNEKGNSSLK LEFTPGMAED A VGDSAPLS ...文字列: MSGSIDVITH FGPDADKPEI ITALENLTKL HALSVEDLYI KWEQFSNQRR QTHTDLTSKN IDEFKQFLQL QMEKRANQIS SSSKVNTST KKPVIKKSLN SSPLFGLSIP KTPTLKKRKL HGPFSLSDSK QTYNVGSEAE TNEKGNSSLK LEFTPGMAED A VGDSAPLS HAKSSDAKTP GSSTFQTPTT NTPTTSRQNV PAGEILDSLN PENIEISSGN PNVGLLSTEE PSYNQVKVEP FY DAKKYKF RTMRQNLQEA SDVLDDQIES FTKIIQNHYK LSPNDFADPT IQSQSEIYAV GRIVPDSPTY DKFLNPESLS LET SRMGGV GRRVRLDLSQ VNELSFFLGQ IVAFKGKNAN GDYFTVNSIL PLPYPNSPVS TSQELQEFQA NLEGSSLKVI VTCG PYFAN DNFSLELLQE FIDSINNEVK PHVLIMFGPF IDITHPLIAS GKLPNFPQFK TQPKTLDELF LKLFTPILKT ISPHI QTVL IPSTKDAISN HAAYPQASLI RKALQLPKRN FKCMANPSSF QINEIYFGCS NVDTFKDLKE VIKGGTTSSR YRLDRV SEH ILQQRRYYPI FPGSIRTRIK PKDVSTKKET NDMESKEEKV YEHISGADLD VSYLGLTEFV GGFSPDIMII PSELQHF AR VVQNVVVINP GRFIRATGNR GSYAQITVQC PDLEDGKLTL VEGEEPVYLH NVWKRARVDL IAS UniProtKB: DNA polymerase alpha subunit B |
-分子 #5: template DNA
| 分子 | 名称: template DNA / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 6.288023 KDa |
| 配列 | 文字列: (DT)(DG)(DT)(DC)(DC)(DC)(DC)(DT)(DC)(DG) (DC)(DT)(DG)(DC)(DC)(DG)(DC)(DC)(DG)(DC) (DC) |
-分子 #6: RNA-DNA chimeric primer
| 分子 | 名称: RNA-DNA chimeric primer / タイプ: rna / ID: 6 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 4.603852 KDa |
| 配列 | 文字列: AGGCGGGCAG CGAA |
-分子 #7: IRON/SULFUR CLUSTER
| 分子 | 名称: IRON/SULFUR CLUSTER / タイプ: ligand / ID: 7 / コピー数: 1 / 式: SF4 |
|---|---|
| 分子量 | 理論値: 351.64 Da |
| Chemical component information |  ChemComp-FS1: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | #0 - Image recording ID: 1 #0 - フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) #0 - 平均電子線量: 60.0 e/Å2 / #1 - Image recording ID: 2 #1 - フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) #1 - 平均電子線量: 50.0 e/Å2 / #2 - Image recording ID: 3 #2 - フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) #2 - 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析 #1
画像解析 #1
+ 画像解析 #2
画像解析 #2
- 画像解析 #3
画像解析 #3
| Image processing ID | 3 |
|---|---|
| Image recording ID | 3 |
| 初期モデル | モデルのタイプ: NONE |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)