+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
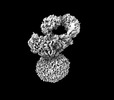
| タイトル | IgM BCR fab truncated form | |||||||||
 マップデータ マップデータ | IgM BCR_Delta_Fab | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | complex / membrane protein / IMMUNE SYSTEM | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報CD22 mediated BCR regulation / riboflavin synthase activity / IgM B cell receptor complex / pentameric IgM immunoglobulin complex / B cell receptor complex / Cell surface interactions at the vascular wall / positive regulation of B cell activation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / pre-B cell allelic exclusion / early endosome to late endosome transport ...CD22 mediated BCR regulation / riboflavin synthase activity / IgM B cell receptor complex / pentameric IgM immunoglobulin complex / B cell receptor complex / Cell surface interactions at the vascular wall / positive regulation of B cell activation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / pre-B cell allelic exclusion / early endosome to late endosome transport / B cell affinity maturation / humoral immune response mediated by circulating immunoglobulin / riboflavin biosynthetic process / regulation of cell morphogenesis / regulation of immunoglobulin production / immunoglobulin receptor binding / immunoglobulin complex, circulating / antigen processing and presentation / B cell activation / B cell proliferation / immunoglobulin mediated immune response / positive regulation of endocytosis / antigen binding / positive regulation of B cell proliferation / multivesicular body / bioluminescence / B cell differentiation / B cell receptor signaling pathway / response to bacterium / positive regulation of immune response / transmembrane signaling receptor activity / MAPK cascade / defense response to Gram-negative bacterium / adaptive immune response / positive regulation of MAPK cascade / membrane raft / external side of plasma membrane / perinuclear region of cytoplasm / cell surface / extracellular space / identical protein binding / membrane / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.0 Å | |||||||||
 データ登録者 データ登録者 | Dong Y / Pi X / Wu H / Reth M | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Structural principles of B cell antigen receptor assembly. 著者: Ying Dong / Xiong Pi / Frauke Bartels-Burgahn / Deniz Saltukoglu / Zhuoyi Liang / Jianying Yang / Frederick W Alt / Michael Reth / Hao Wu /   要旨: The B cell antigen receptor (BCR) is composed of a membrane-bound class M, D, G, E or A immunoglobulin for antigen recognition and a disulfide-linked Igα (also known as CD79A) and Igβ (also known ...The B cell antigen receptor (BCR) is composed of a membrane-bound class M, D, G, E or A immunoglobulin for antigen recognition and a disulfide-linked Igα (also known as CD79A) and Igβ (also known as CD79B) heterodimer (Igα/β) that functions as the signalling entity through intracellular immunoreceptor tyrosine-based activation motifs (ITAMs). The organizing principle of the BCR remains unknown. Here we report cryo-electron microscopy structures of mouse full-length IgM BCR and its Fab-deleted form. At the ectodomain (ECD), the Igα/β heterodimer mainly uses Igα to associate with Cµ3 and Cµ4 domains of one heavy chain (µHC) while leaving the other heavy chain (µHC') unbound. The transmembrane domain (TMD) helices of µHC and µHC' interact with those of the Igα/β heterodimer to form a tight four-helix bundle. The asymmetry at the TMD prevents the recruitment of two Igα/β heterodimers. Notably, the connecting peptide between the ECD and TMD of µHC intervenes in between those of Igα and Igβ to guide TMD assembly through charge complementarity. Weaker but distinct density for the Igβ ITAM nestles next to the TMD, suggesting potential autoinhibition of ITAM phosphorylation. Interfacial analyses suggest that all BCR classes utilize a general organizational architecture. Our studies provide a structural platform for understanding B cell signalling and designing rational therapies against BCR-mediated diseases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27888.map.gz emd_27888.map.gz | 129.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27888-v30.xml emd-27888-v30.xml emd-27888.xml emd-27888.xml | 22.1 KB 22.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27888.png emd_27888.png | 58.9 KB | ||
| Filedesc metadata |  emd-27888.cif.gz emd-27888.cif.gz | 7.1 KB | ||
| その他 |  emd_27888_half_map_1.map.gz emd_27888_half_map_1.map.gz emd_27888_half_map_2.map.gz emd_27888_half_map_2.map.gz | 127.1 MB 127.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27888 http://ftp.pdbj.org/pub/emdb/structures/EMD-27888 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27888 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27888 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27888_validation.pdf.gz emd_27888_validation.pdf.gz | 893.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27888_full_validation.pdf.gz emd_27888_full_validation.pdf.gz | 893.2 KB | 表示 | |
| XML形式データ |  emd_27888_validation.xml.gz emd_27888_validation.xml.gz | 13.9 KB | 表示 | |
| CIF形式データ |  emd_27888_validation.cif.gz emd_27888_validation.cif.gz | 16.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27888 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27888 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27888 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27888 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27888.map.gz / 形式: CCP4 / 大きさ: 137.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27888.map.gz / 形式: CCP4 / 大きさ: 137.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | IgM BCR_Delta_Fab | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: IgM BCR Delta Fab
| ファイル | emd_27888_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | IgM BCR_Delta_Fab | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
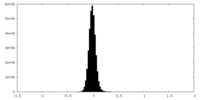
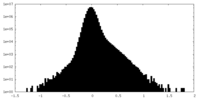
| 密度ヒストグラム |
-ハーフマップ: IgM BCR Delta Fab
| ファイル | emd_27888_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | IgM BCR_Delta_Fab | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
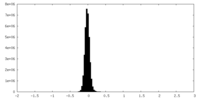
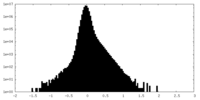
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : BCR complex
| 全体 | 名称: BCR complex |
|---|---|
| 要素 |
|
-超分子 #1: BCR complex
| 超分子 | 名称: BCR complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Isoform 2 of Immunoglobulin heavy constant mu
| 分子 | 名称: Isoform 2 of Immunoglobulin heavy constant mu / タイプ: protein_or_peptide / ID: 1 詳細: B1-8 leader sequence: MGWSCIILFLVATATGVHS Strep Tag: WSHPQFEK Rigid linker: AEAAAKEAAAKEAAAKA コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 45.753785 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGWSCIILFL VATATGVHSG GWSHPQFEKA EAAAKEAAAK EAAAKAAVAE MNPNVNVFVP PRDGFSGPAP RKSKLICEAT NFTPKPITV SWLKDGKLVE SGFTTDPVTI ENKGSTPQTY KVISTLTISE IDWLNLNVYT CRVDHRGLTF LKNVSSTCAA S PSTDILTF ...文字列: MGWSCIILFL VATATGVHSG GWSHPQFEKA EAAAKEAAAK EAAAKAAVAE MNPNVNVFVP PRDGFSGPAP RKSKLICEAT NFTPKPITV SWLKDGKLVE SGFTTDPVTI ENKGSTPQTY KVISTLTISE IDWLNLNVYT CRVDHRGLTF LKNVSSTCAA S PSTDILTF TIPPSFADIF LSKSANLTCL VSNLATYETL NISWASQSGE PLETKIKIME SHPNGTFSAK GVASVCVEDW NN RKEFVCT VTHRDLPSPQ KKFISKPNEV HKHPPAVYLL PPAREQLNLR ESATVTCLVK GFSPADISVQ WLQRGQLLPQ EKY VTSAPM PEPGAPGFYF THSILTVTEE EWNSGETYTC VVGHEALPHL VTERTVDKST EGEVNAEEEG FENLWTTAST FIVL FLLSL FYSTTVTLFK VK UniProtKB: Immunoglobulin heavy constant mu |
-分子 #2: B-cell antigen receptor complex-associated protein alpha chain,Ye...
| 分子 | 名称: B-cell antigen receptor complex-associated protein alpha chain,Yellow fluorescent protein タイプ: protein_or_peptide / ID: 2 詳細: Flag tag:DYKDDDDK Linker: RSIATRS,Flag tag:DYKDDDDK Linker: RSIATRS YFP: ...詳細: Flag tag:DYKDDDDK Linker: RSIATRS,Flag tag:DYKDDDDK Linker: RSIATRS YFP:MFKGIVEGIGIIEKIDIYTDLDKYAIRFPENMLNGIKKESSIMFNGCFLTVTSVNSNIVWFDIFEKEARKLDTFREYKVGDRVNLGTFPKFGAASGGHILSARISCVASIIEIIENEDYQQMWIQIPENFTEFLIDKDYIAVDGISLTIDTIKNNQFFISLPLKIAQNTNMKWRKKGDKVNVELSNKINANQCW,Flag コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 42.83723 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: DYKDDDDKMP GGLEALRALP LLLFLSYACL GPGCQALRVE GGPPSLTVNL GEEARLTCEN NGRNPNITWW FSLQSNITWP PVPLGPGQG TTGQLFFPEV NKNHRGLYWC QVIENNILKR SCGTYLRVRN PVPRPFLDMG EGTKNRIITA EGIILLFCAV V PGTLLLFR ...文字列: DYKDDDDKMP GGLEALRALP LLLFLSYACL GPGCQALRVE GGPPSLTVNL GEEARLTCEN NGRNPNITWW FSLQSNITWP PVPLGPGQG TTGQLFFPEV NKNHRGLYWC QVIENNILKR SCGTYLRVRN PVPRPFLDMG EGTKNRIITA EGIILLFCAV V PGTLLLFR KRWQNEKFGR SIATRSMFKG IVEGIGIIEK IDIYTDLDKY AIRFPENMLN GIKKESSIMF NGCFLTVTSV NS NIVWFDI FEKEARKLDT FREYKVGDRV NLGTFPKFGA ASGGHILSAR ISCVASIIEI IENEDYQQMW IQIPENFTEF LID KDYIAV DGISLTIDTI KNNQFFISLP LKIAQNTNMK WRKKGDKVNV ELSNKINANQ CW UniProtKB: B-cell antigen receptor complex-associated protein alpha chain, Yellow fluorescent protein |
-分子 #3: B-cell antigen receptor complex-associated protein beta chain
| 分子 | 名称: B-cell antigen receptor complex-associated protein beta chain タイプ: protein_or_peptide / ID: 3 / 詳細: full length cd79b / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 25.752375 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MATLVLSSMP CHWLLFLLLL FSGEPVPAMT SSDLPLNFQG SPCSQIWQHP RFAAKKRSSM VKFHCYTNHS GALTWFRKRG SQQPQELVS EEGRIVQTQN GSVYTLTIQN IQYEDNGIYF CKQKCDSANH NVTDSCGTEL LVLGFSTLDQ LKRRNTLKDG I ILIQTLLI ...文字列: MATLVLSSMP CHWLLFLLLL FSGEPVPAMT SSDLPLNFQG SPCSQIWQHP RFAAKKRSSM VKFHCYTNHS GALTWFRKRG SQQPQELVS EEGRIVQTQN GSVYTLTIQN IQYEDNGIYF CKQKCDSANH NVTDSCGTEL LVLGFSTLDQ LKRRNTLKDG I ILIQTLLI ILFIIVPIFL LLDKDDGKAG MEEDHTYEGL NIDQTATYED IVTLRTGEVK WSVGEHPGQE UniProtKB: B-cell antigen receptor complex-associated protein beta chain |
-分子 #4: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 4 / 詳細: full length cd79b / コピー数: 5 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.9 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 1.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)