+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Mycobacterium phage Che8 | |||||||||
 マップデータ マップデータ | Sharpened map of Ewald sphere corrected Che8_postprocess | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | HK97-fold / T=9 / tailed bacteriophage / VIRUS | |||||||||
| 機能・相同性 | Major capsid protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Mycobacterium virus Che8 (ウイルス) / Mycobacterium virus Che8 (ウイルス) /  Mycobacterium phage Che8 (ファージ) Mycobacterium phage Che8 (ファージ) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.5 Å | |||||||||
 データ登録者 データ登録者 | Podgorski JM / White SJ | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: A structural dendrogram of the actinobacteriophage major capsid proteins provides important structural insights into the evolution of capsid stability. 著者: Jennifer M Podgorski / Krista Freeman / Sophia Gosselin / Alexis Huet / James F Conway / Mary Bird / John Grecco / Shreya Patel / Deborah Jacobs-Sera / Graham Hatfull / Johann Peter Gogarten ...著者: Jennifer M Podgorski / Krista Freeman / Sophia Gosselin / Alexis Huet / James F Conway / Mary Bird / John Grecco / Shreya Patel / Deborah Jacobs-Sera / Graham Hatfull / Johann Peter Gogarten / Janne Ravantti / Simon J White /   要旨: Many double-stranded DNA viruses, including tailed bacteriophages (phages) and herpesviruses, use the HK97-fold in their major capsid protein to make the capsomers of the icosahedral viral capsid. ...Many double-stranded DNA viruses, including tailed bacteriophages (phages) and herpesviruses, use the HK97-fold in their major capsid protein to make the capsomers of the icosahedral viral capsid. After the genome packaging at near-crystalline densities, the capsid is subjected to a major expansion and stabilization step that allows it to withstand environmental stresses and internal high pressure. Several different mechanisms for stabilizing the capsid have been structurally characterized, but how these mechanisms have evolved is still not understood. Using cryo-EM structure determination of 10 capsids, structural comparisons, phylogenetic analyses, and Alphafold predictions, we have constructed a detailed structural dendrogram describing the evolution of capsid structural stability within the actinobacteriophages. We show that the actinobacteriophage major capsid proteins can be classified into 15 groups based upon their HK97-fold. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27824.map.gz emd_27824.map.gz | 1.7 GB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27824-v30.xml emd-27824-v30.xml emd-27824.xml emd-27824.xml | 22.4 KB 22.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27824.png emd_27824.png | 275.6 KB | ||
| Filedesc metadata |  emd-27824.cif.gz emd-27824.cif.gz | 5.8 KB | ||
| その他 |  emd_27824_additional_1.map.gz emd_27824_additional_1.map.gz emd_27824_additional_2.map.gz emd_27824_additional_2.map.gz emd_27824_half_map_1.map.gz emd_27824_half_map_1.map.gz emd_27824_half_map_2.map.gz emd_27824_half_map_2.map.gz | 1.8 GB 1.6 GB 1.5 GB 1.5 GB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27824 http://ftp.pdbj.org/pub/emdb/structures/EMD-27824 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27824 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27824 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27824_validation.pdf.gz emd_27824_validation.pdf.gz | 999.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27824_full_validation.pdf.gz emd_27824_full_validation.pdf.gz | 998.8 KB | 表示 | |
| XML形式データ |  emd_27824_validation.xml.gz emd_27824_validation.xml.gz | 26 KB | 表示 | |
| CIF形式データ |  emd_27824_validation.cif.gz emd_27824_validation.cif.gz | 30.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27824 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27824 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27824 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27824 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8e16MC  8eb4C  8ec2C  8ec8C  8eciC  8ecjC  8eckC  8ecnC  8ecoC  8eduC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27824.map.gz / 形式: CCP4 / 大きさ: 1.9 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27824.map.gz / 形式: CCP4 / 大きさ: 1.9 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map of Ewald sphere corrected Che8_postprocess | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.0624 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Ewald sphere corrected map of 3DRefine After CTFRefine
| ファイル | emd_27824_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Ewald sphere corrected map of 3DRefine_After_CTFRefine | ||||||||||||
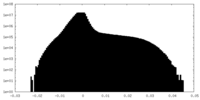
| 投影像・断面図 |
| ||||||||||||
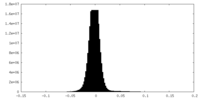
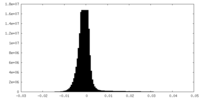
| 密度ヒストグラム |
-追加マップ: Map before Ewald sphere correction
| ファイル | emd_27824_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map before Ewald sphere correction | ||||||||||||
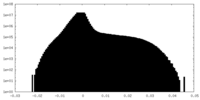
| 投影像・断面図 |
| ||||||||||||
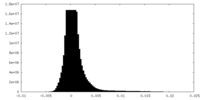
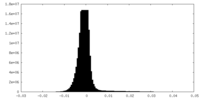
| 密度ヒストグラム |
-ハーフマップ: Half map of Ewald sphere corrected 3DRefine After CTFRefine
| ファイル | emd_27824_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map of Ewald sphere corrected 3DRefine_After_CTFRefine | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
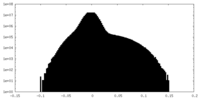
| 密度ヒストグラム |
-ハーフマップ: Half map of Ewald sphere corrected 3DRefine After CTFRefine
| ファイル | emd_27824_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map of Ewald sphere corrected 3DRefine_After_CTFRefine | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
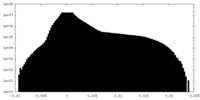
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Mycobacterium phage Che8
| 全体 | 名称:  Mycobacterium phage Che8 (ファージ) Mycobacterium phage Che8 (ファージ) |
|---|---|
| 要素 |
|
-超分子 #1: Mycobacterium phage Che8
| 超分子 | 名称: Mycobacterium phage Che8 / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 2907829 / 生物種: Mycobacterium phage Che8 / ウイルスタイプ: VIRION / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:  Mycolicibacterium smegmatis MC2 155 (バクテリア) Mycolicibacterium smegmatis MC2 155 (バクテリア) |
| ウイルス殻 | Shell ID: 1 / 直径: 730.0 Å / T番号(三角分割数): 9 |
-分子 #1: Major capsid protein, gp6
| 分子 | 名称: Major capsid protein, gp6 / タイプ: protein_or_peptide / ID: 1 / コピー数: 9 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Mycobacterium virus Che8 (ウイルス) Mycobacterium virus Che8 (ウイルス) |
| 分子量 | 理論値: 29.075291 KDa |
| 配列 | 文字列: MAFNNFIPEL WSDMLLEEWT AQTVFANLVN REYEGIASKG NVVHIAGVVA PTVKDYKAAG RQTSADAISD TGVDLLIDQE KSIDFLVDD IDRVQVAGSL EAYTRAGATA LATDTDKFIA DMLVDNGTAL TGSAPSDADD AFDLIASALK ELTKANVPNV G RVVVVNAE ...文字列: MAFNNFIPEL WSDMLLEEWT AQTVFANLVN REYEGIASKG NVVHIAGVVA PTVKDYKAAG RQTSADAISD TGVDLLIDQE KSIDFLVDD IDRVQVAGSL EAYTRAGATA LATDTDKFIA DMLVDNGTAL TGSAPSDADD AFDLIASALK ELTKANVPNV G RVVVVNAE MAFWLRSSGS KLTSADTSGD AAGLRAGTIG NLLGARIVES NNLRDTDDEQ FVAFHPSAAA YVSQIDTVEA LR DQDSFSD RIRALHVYGG KVVRPTGVVV FNKTGS UniProtKB: Major capsid protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 10 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
| グリッド | モデル: C-flat-2/2 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 実像数: 1201 / 平均電子線量: 1.07 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Amino acid sequence built into the map for a single major capsid protein and refined with Phenix. Model then used for rest of asymmetric unit and refined with Phenix. Final step involved using Isolde. |
|---|---|
| 精密化 | プロトコル: AB INITIO MODEL |
| 得られたモデル |  PDB-8e16: |
 ムービー
ムービー コントローラー
コントローラー













 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)