+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2752 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the ryanodine receptor at resolution of 8.5 A in partially open state | |||||||||
 マップデータ マップデータ | reconstruction of ryanodine receptor 1 in partially open state | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | calcium binding / ion channel / muscular contraction / conformational changes. | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-gated ion channel activity / terminal cisterna / ryanodine receptor complex / ryanodine-sensitive calcium-release channel activity / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / cellular response to caffeine / skin development / organelle membrane / smooth endoplasmic reticulum ...ATP-gated ion channel activity / terminal cisterna / ryanodine receptor complex / ryanodine-sensitive calcium-release channel activity / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / ossification involved in bone maturation / cellular response to caffeine / skin development / organelle membrane / smooth endoplasmic reticulum / intracellularly gated calcium channel activity / outflow tract morphogenesis / toxic substance binding / striated muscle contraction / voltage-gated calcium channel activity / skeletal muscle fiber development / release of sequestered calcium ion into cytosol / sarcoplasmic reticulum membrane / muscle contraction / cellular response to calcium ion / sarcoplasmic reticulum / sarcolemma / calcium ion transmembrane transport / calcium channel activity / Z disc / intracellular calcium ion homeostasis / disordered domain specific binding / protein homotetramerization / transmembrane transporter binding / calmodulin binding / calcium ion binding / ATP binding / identical protein binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.5 Å | |||||||||
 データ登録者 データ登録者 | Efremov RG / Leitner A / Aebersold R / Raunser S | |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2015 ジャーナル: Nature / 年: 2015タイトル: Architecture and conformational switch mechanism of the ryanodine receptor. 著者: Rouslan G Efremov / Alexander Leitner / Ruedi Aebersold / Stefan Raunser /    要旨: Muscle contraction is initiated by the release of calcium (Ca(2+)) from the sarcoplasmic reticulum into the cytoplasm of myocytes through ryanodine receptors (RyRs). RyRs are homotetrameric channels ...Muscle contraction is initiated by the release of calcium (Ca(2+)) from the sarcoplasmic reticulum into the cytoplasm of myocytes through ryanodine receptors (RyRs). RyRs are homotetrameric channels with a molecular mass of more than 2.2 megadaltons that are regulated by several factors, including ions, small molecules and proteins. Numerous mutations in RyRs have been associated with human diseases. The molecular mechanism underlying the complex regulation of RyRs is poorly understood. Using electron cryomicroscopy, here we determine the architecture of rabbit RyR1 at a resolution of 6.1 Å. We show that the cytoplasmic moiety of RyR1 contains two large α-solenoid domains and several smaller domains, with folds suggestive of participation in protein-protein interactions. The transmembrane domain represents a chimaera of voltage-gated sodium and pH-activated ion channels. We identify the calcium-binding EF-hand domain and show that it functions as a conformational switch allosterically gating the channel. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2752.map.gz emd_2752.map.gz | 2.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2752-v30.xml emd-2752-v30.xml emd-2752.xml emd-2752.xml | 12.3 KB 12.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
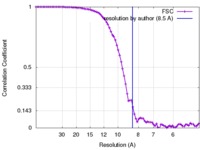
| FSC (解像度算出) |  emd_2752_fsc.xml emd_2752_fsc.xml | 7.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_2752.jpg emd_2752.jpg | 50 KB | ||
| マスクデータ |  emd_2752_msk_1.map emd_2752_msk_1.map | 42.9 MB |  マスクマップ マスクマップ | |
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2752 http://ftp.pdbj.org/pub/emdb/structures/EMD-2752 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2752 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2752 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2752_validation.pdf.gz emd_2752_validation.pdf.gz | 290.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2752_full_validation.pdf.gz emd_2752_full_validation.pdf.gz | 290 KB | 表示 | |
| XML形式データ |  emd_2752_validation.xml.gz emd_2752_validation.xml.gz | 10 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2752 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2752 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2752 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2752 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2752.map.gz / 形式: CCP4 / 大きさ: 41.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2752.map.gz / 形式: CCP4 / 大きさ: 41.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | reconstruction of ryanodine receptor 1 in partially open state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.59 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-セグメンテーションマップ: mask used for calculating FSC curve
| 注釈 | mask used for calculating FSC curve | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ファイル |  emd_2752_msk_1.map emd_2752_msk_1.map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ryanodine receptor 1 (calcium release channel) from rabbit
| 全体 | 名称: Ryanodine receptor 1 (calcium release channel) from rabbit |
|---|---|
| 要素 |
|
-超分子 #1000: Ryanodine receptor 1 (calcium release channel) from rabbit
| 超分子 | 名称: Ryanodine receptor 1 (calcium release channel) from rabbit タイプ: sample / ID: 1000 / 詳細: protein was reconstituted in lipid nanodiscs / 集合状態: tetramer / Number unique components: 1 |
|---|---|
| 分子量 | 理論値: 2.26 MDa |
-分子 #1: Ryanodine receptor 1
| 分子 | 名称: Ryanodine receptor 1 / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Skeletal muscle calcium release channel / コピー数: 4 / 集合状態: tetramer / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 2.26 MDa |
| 配列 | UniProtKB: Ryanodine receptor 1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 10 mM MOPS, 200 mM NaCl, 10mM CaCl2, 2mM DTT, 0.2% fluorinated octyl-maltoside |
| グリッド | 詳細: C-Flat CF-1.2/1.3-4C holey carbon grid |
| 凍結 | 凍結剤: ETHANE / 装置: GATAN CRYOPLUNGE 3 手法: protein solution was applied on glow discharged grid and blotted for 1.5 seconds before plunging |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3200FSC |
|---|---|
| 温度 | 最低: 80 K |
| 特殊光学系 | エネルギーフィルター - 名称: in-column omega energy filter エネルギーフィルター - エネルギー下限: 0.0 eV エネルギーフィルター - エネルギー上限: 15.0 eV |
| 日付 | 2012年3月12日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F816 (8k x 8k) 実像数: 1041 / 平均電子線量: 20 e/Å2 詳細: Images were collected automatically with EM-TOOLS software |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 4.1 mm / 最大 デフォーカス(公称値): 0.0039 µm / 最小 デフォーカス(公称値): 0.0009 µm / 倍率(公称値): 60000 |
| 試料ステージ | 試料ホルダー: liquid nitorgen cooled / 試料ホルダーモデル: JEOL 3200FSC CRYOHOLDER |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)