+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1) | |||||||||
 マップデータ マップデータ | Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | moPrP23-144 / amyloid / prion diseases / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process / regulation of glutamate receptor signaling pathway / lamin binding / aspartic-type endopeptidase inhibitor activity / regulation of calcium ion import across plasma membrane / positive regulation of glutamate receptor signaling pathway / glycosaminoglycan binding / type 5 metabotropic glutamate receptor binding / ATP-dependent protein binding ...Insertion of tail-anchored proteins into the endoplasmic reticulum membrane / negative regulation of amyloid precursor protein catabolic process / regulation of glutamate receptor signaling pathway / lamin binding / aspartic-type endopeptidase inhibitor activity / regulation of calcium ion import across plasma membrane / positive regulation of glutamate receptor signaling pathway / glycosaminoglycan binding / type 5 metabotropic glutamate receptor binding / ATP-dependent protein binding / negative regulation of interleukin-17 production / cupric ion binding / regulation of potassium ion transmembrane transport / negative regulation of dendritic spine maintenance / nucleobase-containing compound metabolic process / negative regulation of calcineurin-NFAT signaling cascade / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / negative regulation of activated T cell proliferation / negative regulation of amyloid-beta formation / cuprous ion binding / response to amyloid-beta / negative regulation of type II interferon production / negative regulation of long-term synaptic potentiation / intracellular copper ion homeostasis / positive regulation of protein targeting to membrane / response to cadmium ion / side of membrane / inclusion body / neuron projection maintenance / positive regulation of calcium-mediated signaling / cellular response to copper ion / molecular function activator activity / positive regulation of protein localization to plasma membrane / molecular condensate scaffold activity / protein destabilization / protein homooligomerization / cellular response to xenobiotic stimulus / cellular response to amyloid-beta / terminal bouton / positive regulation of neuron apoptotic process / signaling receptor activity / regulation of protein localization / protein-folding chaperone binding / amyloid-beta binding / response to oxidative stress / protease binding / nuclear membrane / microtubule binding / molecular adaptor activity / transmembrane transporter binding / learning or memory / postsynaptic density / intracellular signal transduction / membrane raft / copper ion binding / dendrite / negative regulation of apoptotic process / protein-containing complex binding / cell surface / endoplasmic reticulum / negative regulation of transcription by RNA polymerase II / Golgi apparatus / metal ion binding / identical protein binding / membrane / plasma membrane / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.92 Å | |||||||||
 データ登録者 データ登録者 | Li Q / Surewicz WK | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2022 ジャーナル: Nat Struct Mol Biol / 年: 2022タイトル: Cryo-EM structure of disease-related prion fibrils provides insights into seeding barriers. 著者: Qiuye Li / Christopher P Jaroniec / Witold K Surewicz /  要旨: One of the least understood aspects of prion diseases is the structure of infectious prion protein aggregates. Here we report a high-resolution cryo-EM structure of amyloid fibrils formed by human ...One of the least understood aspects of prion diseases is the structure of infectious prion protein aggregates. Here we report a high-resolution cryo-EM structure of amyloid fibrils formed by human prion protein with the Y145Stop mutation that is associated with a familial prion disease. This structural insight allows us not only to explain previous biochemical findings, but also provides direct support for the conformational adaptability model of prion transmissibility barriers. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27458.map.gz emd_27458.map.gz | 2.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27458-v30.xml emd-27458-v30.xml emd-27458.xml emd-27458.xml | 17.8 KB 17.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27458.png emd_27458.png | 174.1 KB | ||
| Filedesc metadata |  emd-27458.cif.gz emd-27458.cif.gz | 5.9 KB | ||
| その他 |  emd_27458_half_map_1.map.gz emd_27458_half_map_1.map.gz emd_27458_half_map_2.map.gz emd_27458_half_map_2.map.gz | 987.7 KB 984.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27458 http://ftp.pdbj.org/pub/emdb/structures/EMD-27458 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27458 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27458 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27458_validation.pdf.gz emd_27458_validation.pdf.gz | 562 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27458_full_validation.pdf.gz emd_27458_full_validation.pdf.gz | 561.6 KB | 表示 | |
| XML形式データ |  emd_27458_validation.xml.gz emd_27458_validation.xml.gz | 7.3 KB | 表示 | |
| CIF形式データ |  emd_27458_validation.cif.gz emd_27458_validation.cif.gz | 8.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27458 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27458 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27458 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27458 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8djaMC  7rl4C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27458.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27458.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1) | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.828 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1)
| ファイル | emd_27458_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
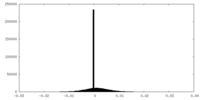
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1)
| ファイル | emd_27458_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of mouse PrP23-144 amyloid fibrils (polymorph 1) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Amyloid fibrils formed by moPrP23-144
| 全体 | 名称: Amyloid fibrils formed by moPrP23-144 |
|---|---|
| 要素 |
|
-超分子 #1: Amyloid fibrils formed by moPrP23-144
| 超分子 | 名称: Amyloid fibrils formed by moPrP23-144 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Major prion protein
| 分子 | 名称: Major prion protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 20 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 12.398579 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSKKRPKPGG WNTGGSRYPG QGSPGGNRYP PQGGTWGQPH GGGWGQPHGG SWGQPHGGSW GQPHGGGWGQ GGGTHNQWNK PSKPKTNLK HVAGAAAAGA VVGGLGGYML GSAMSRPMIH FGND UniProtKB: Major prion protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 6.5 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 4.74 Å 想定した対称性 - らせんパラメータ - ΔΦ: -2.36 ° 想定した対称性 - らせんパラメータ - 軸対称性: C2 (2回回転対称) 解像度のタイプ: BY AUTHOR / 解像度: 3.92 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 10628 |
|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION |
| 初期モデル | モデルのタイプ: NONE |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)