+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Tailpiece local refinement for integrin alphaM/beta2 ectodomain in complex with adenylate cyclase toxin RTX751 and M1F5 Fab | |||||||||
 マップデータ マップデータ | Tailpiece local refinement unsharpened map | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
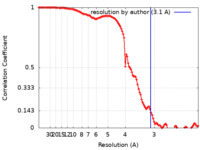
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Goldsmith JA / McLellan JS | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell Rep / 年: 2022 ジャーナル: Cell Rep / 年: 2022タイトル: Structural basis for non-canonical integrin engagement by Bordetella adenylate cyclase toxin. 著者: Jory A Goldsmith / Andrea M DiVenere / Jennifer A Maynard / Jason S McLellan /  要旨: Integrins are ubiquitous cell-surface heterodimers that are exploited by pathogens and toxins, including leukotoxins that target β integrins on phagocytes. The Bordetella adenylate cyclase toxin ...Integrins are ubiquitous cell-surface heterodimers that are exploited by pathogens and toxins, including leukotoxins that target β integrins on phagocytes. The Bordetella adenylate cyclase toxin (ACT) uses the αβ integrin as a receptor, but the structural basis for integrin binding and neutralization by antibodies is poorly understood. Here, we use cryoelectron microscopy to determine a 2.7 Å resolution structure of an ACT fragment bound to αβ. This structure reveals that ACT interacts with the headpiece and calf-2 of the α subunit in a non-canonical manner specific to bent, inactive αβ. Neutralizing antibody epitopes map to ACT residues involved in α binding, providing the basis for antibody-mediated attachment inhibition. Furthermore, binding to αβ positions the essential ACT acylation sites, which are conserved among toxins exported by type I secretion systems, at the cell membrane. These findings reveal a structural mechanism for integrin-mediated attachment and explain antibody-mediated neutralization of ACT intoxication. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27123.map.gz emd_27123.map.gz | 71.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27123-v30.xml emd-27123-v30.xml emd-27123.xml emd-27123.xml | 15 KB 15 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_27123_fsc.xml emd_27123_fsc.xml | 11.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27123.png emd_27123.png | 35.1 KB | ||
| その他 |  emd_27123_additional_1.map.gz emd_27123_additional_1.map.gz emd_27123_half_map_1.map.gz emd_27123_half_map_1.map.gz emd_27123_half_map_2.map.gz emd_27123_half_map_2.map.gz | 128.2 MB 135.1 MB 135.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27123 http://ftp.pdbj.org/pub/emdb/structures/EMD-27123 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27123 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27123 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27123_validation.pdf.gz emd_27123_validation.pdf.gz | 709.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27123_full_validation.pdf.gz emd_27123_full_validation.pdf.gz | 708.7 KB | 表示 | |
| XML形式データ |  emd_27123_validation.xml.gz emd_27123_validation.xml.gz | 19.2 KB | 表示 | |
| CIF形式データ |  emd_27123_validation.cif.gz emd_27123_validation.cif.gz | 24.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27123 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27123 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27123 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27123 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27123.map.gz / 形式: CCP4 / 大きさ: 147.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27123.map.gz / 形式: CCP4 / 大きさ: 147.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Tailpiece local refinement unsharpened map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.073 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Tailpiece local refinement sharpened map (DeepEMhancer)
| ファイル | emd_27123_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Tailpiece local refinement sharpened map (DeepEMhancer) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Tailpiece local refinement half-map A
| ファイル | emd_27123_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Tailpiece local refinement half-map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Tailpiece local refinement half-map B
| ファイル | emd_27123_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Tailpiece local refinement half-map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ternary complex of integrin alphaM/beta2 ectodomain with adenylat...
| 全体 | 名称: Ternary complex of integrin alphaM/beta2 ectodomain with adenylate cyclase toxin RTX domain and M1F5 Fab |
|---|---|
| 要素 |
|
-超分子 #1: Ternary complex of integrin alphaM/beta2 ectodomain with adenylat...
| 超分子 | 名称: Ternary complex of integrin alphaM/beta2 ectodomain with adenylate cyclase toxin RTX domain and M1F5 Fab タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: #1-#5 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 80.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)