+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of nanodisc-embedded human ABCA1 | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | sterol transport / ABC transporter / phospholipid transport / MEMBRANE PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報sphingolipid floppase activity / regulation of high-density lipoprotein particle assembly / apolipoprotein A-I receptor activity / positive regulation of high-density lipoprotein particle assembly / Defective ABCA1 causes TGD / signal release / response to laminar fluid shear stress / intracellular cholesterol transport / apolipoprotein A-I binding / platelet dense granule organization ...sphingolipid floppase activity / regulation of high-density lipoprotein particle assembly / apolipoprotein A-I receptor activity / positive regulation of high-density lipoprotein particle assembly / Defective ABCA1 causes TGD / signal release / response to laminar fluid shear stress / intracellular cholesterol transport / apolipoprotein A-I binding / platelet dense granule organization / phospholipid transporter activity / high-density lipoprotein particle binding / HDL assembly / protein transmembrane transport / phosphatidylserine floppase activity / floppase activity / peptide secretion / cellular response to cholesterol / phospholipid efflux / phosphatidylcholine floppase activity / reverse cholesterol transport / phospholipid homeostasis / high-density lipoprotein particle assembly / phosphatidylcholine binding / lipoprotein biosynthetic process / cholesterol transfer activity / export across plasma membrane / P-type phospholipid transporter / response to vitamin B3 / regulation of Cdc42 protein signal transduction / syntaxin binding / cholesterol efflux / phospholipid translocation / endosomal transport / lysosome organization / cholesterol binding / phagocytosis, engulfment / negative regulation of cholesterol storage / intracellular vesicle / cellular response to cytokine stimulus / negative regulation of macrophage derived foam cell differentiation / cellular response to low-density lipoprotein particle stimulus / protein secretion / apolipoprotein binding / protein transmembrane transporter activity / positive regulation of cholesterol efflux / endocytic vesicle / ATPase-coupled transmembrane transporter activity / ABC-type transporter activity / cholesterol metabolic process / NR1H3 & NR1H2 regulate gene expression linked to cholesterol transport and efflux / phagocytic vesicle / cellular response to retinoic acid / cholesterol homeostasis / PPARA activates gene expression / small GTPase binding / cellular response to xenobiotic stimulus / adenylate cyclase-activating G protein-coupled receptor signaling pathway / ATPase binding / cellular response to lipopolysaccharide / basolateral plasma membrane / endosome / G protein-coupled receptor signaling pathway / membrane raft / signaling receptor binding / external side of plasma membrane / intracellular membrane-bounded organelle / endoplasmic reticulum membrane / perinuclear region of cytoplasm / Golgi apparatus / ATP hydrolysis activity / ATP binding / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
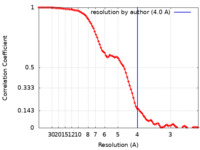
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.0 Å | ||||||||||||
 データ登録者 データ登録者 | Plummer AM / Culbertson AT / Morales-Perez CL / Liao M | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: J Mol Biol / 年: 2023 ジャーナル: J Mol Biol / 年: 2023タイトル: Activity and Structural Dynamics of Human ABCA1 in a Lipid Membrane. 著者: Ashlee M Plummer-Medeiros / Alan T Culbertson / Claudio L Morales-Perez / Maofu Liao /   要旨: The human ATP-binding cassette (ABC) transporter ABCA1 plays a critical role in lipid homeostasis as it extracts sterols and phospholipids from the plasma membrane for excretion to the extracellular ...The human ATP-binding cassette (ABC) transporter ABCA1 plays a critical role in lipid homeostasis as it extracts sterols and phospholipids from the plasma membrane for excretion to the extracellular apolipoprotein A-I and subsequent formation of high-density lipoprotein (HDL) particles. Deleterious mutations of ABCA1 lead to sterol accumulation and are associated with atherosclerosis, poor cardiovascular outcomes, cancer, and Alzheimer's disease. The mechanism by which ABCA1 drives lipid movement is poorly understood, and a unified platform to produce active ABCA1 protein for both functional and structural studies has been missing. In this work, we established a stable expression system for both a human cell-based sterol export assay and protein purification for in vitro biochemical and structural studies. ABCA1 produced in this system was active in sterol export and displayed enhanced ATPase activity after reconstitution into a lipid bilayer. Our single-particle cryo-EM study of ABCA1 in nanodiscs showed protein induced membrane curvature, revealed multiple distinct conformations, and generated a structure of nanodisc-embedded ABCA1 at 4.0-Å resolution representing a previously unknown conformation. Comparison of different ABCA1 structures and molecular dynamics simulations demonstrates both concerted domain movements and conformational variations within each domain. Taken together, our platform for producing and characterizing ABCA1 in a lipid membrane enabled us to gain important mechanistic and structural insights and paves the way for investigating modulators that target the functions of ABCA1. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25838.map.gz emd_25838.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25838-v30.xml emd-25838-v30.xml emd-25838.xml emd-25838.xml | 16.9 KB 16.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25838_fsc.xml emd_25838_fsc.xml | 11.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25838.png emd_25838.png | 91.2 KB | ||
| Filedesc metadata |  emd-25838.cif.gz emd-25838.cif.gz | 7.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25838 http://ftp.pdbj.org/pub/emdb/structures/EMD-25838 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25838 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25838 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_25838_validation.pdf.gz emd_25838_validation.pdf.gz | 619.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_25838_full_validation.pdf.gz emd_25838_full_validation.pdf.gz | 618.7 KB | 表示 | |
| XML形式データ |  emd_25838_validation.xml.gz emd_25838_validation.xml.gz | 10.8 KB | 表示 | |
| CIF形式データ |  emd_25838_validation.cif.gz emd_25838_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25838 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25838 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25838 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25838 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7tdtMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25838.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25838.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.24 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human ABCA1 reconstituted into nanodiscs
| 全体 | 名称: Human ABCA1 reconstituted into nanodiscs |
|---|---|
| 要素 |
|
-超分子 #1: Human ABCA1 reconstituted into nanodiscs
| 超分子 | 名称: Human ABCA1 reconstituted into nanodiscs / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Phospholipid-transporting ATPase ABCA1
| 分子 | 名称: Phospholipid-transporting ATPase ABCA1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: P-type phospholipid transporter |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 255.391797 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: GGGASEFVDM ACWPQLRLLL WKNLTFRRRQ TCQLLLEVAW PLFIFLILIS VRLSYPPYEQ HECHFPNKAM PSAGTLPWVQ GIICNANNP CFRYPTPGEA PGVVGNFNKS IVARLFSDAR RLLLYSQKDT SMKDMRKVLR TLQQIKKSSS NLKLQDFLVD N ETFSGFLY ...文字列: GGGASEFVDM ACWPQLRLLL WKNLTFRRRQ TCQLLLEVAW PLFIFLILIS VRLSYPPYEQ HECHFPNKAM PSAGTLPWVQ GIICNANNP CFRYPTPGEA PGVVGNFNKS IVARLFSDAR RLLLYSQKDT SMKDMRKVLR TLQQIKKSSS NLKLQDFLVD N ETFSGFLY HNLSLPKSTV DKMLRADVIL HKVFLQGYQL HLTSLCNGSK SEEMIQLGDQ EVSELCGLPR EKLAAAERVL RS NMDILKP ILRTLNSTSP FPSKELAEAT KTLLHSLGTL AQELFSMRSW SDMRQEVMFL TNVNSSSSST QIYQAVSRIV CGH PEGGGL KIKSLNWYED NNYKALFGGN GTEEDAETFY DNSTTPYCND LMKNLESSPL SRIIWKALKP LLVGKILYTP DTPA TRQVM AEVNKTFQEL AVFHDLEGMW EELSPKIWTF MENSQEMDLV RMLLDSRDND HFWEQQLDGL DWTAQDIVAF LAKHP EDVQ SSNGSVYTWR EAFNETNQAI RTISRFMECV NLNKLEPIAT EVWLINKSME LLDERKFWAG IVFTGITPGS IELPHH VKY KIRMDIDNVE RTNKIKDGYW DPGPRADPFE DMRYVWGGFA YLQDVVEQAI IRVLTGTEKK TGVYMQQMPY PCYVDDI FL RVMSRSMPLF MTLAWIYSVA VIIKGIVYEK EARLKETMRI MGLDNSILWF SWFISSLIPL LVSAGLLVVI LKLGNLLP Y SDPSVVFVFL SVFAVVTILQ CFLISTLFSR ANLAAACGGI IYFTLYLPYV LCVAWQDYVG FTLKIFASLL SPVAFGFGC EYFALFEEQG IGVQWDNLFE SPVEEDGFNL TTSVSMMLFD TFLYGVMTWY IEAVFPGQYG IPRPWYFPCT KSYWFGEESD EKSHPGSNQ KRISEICMEE EPTHLKLGVS IQNLVKVYRD GMKVAVDGLA LNFYEGQITS FLGHNGAGKT TTMSILTGLF P PTSGTAYI LGKDIRSEMS TIRQNLGVCP QHNVLFDMLT VEEHIWFYAR LKGLSEKHVK AEMEQMALDV GLPSSKLKSK TS QLSGGMQ RKLSVALAFV GGSKVVILDE PTAGVDPYSR RGIWELLLKY RQGRTIILST HHMDEADVLG DRIAIISHGK LCC VGSSLF LKNQLGTGYY LTLVKKDVES SLSSCRNSSS TVSYLKKEDS VSQSSSDAGL GSDHESDTLT IDVSAISNLI RKHV SEARL VEDIGHELTY VLPYEAAKEG AFVELFHEID DRLSDLGISS YGISETTLEE IFLKVAEESG VDAETSDGTL PARRN RRAF GDKQSCLRPF TEDDAADPND SDIDPESRET DLLSGMDGKG SYQVKGWKLT QQQFVALLWK RLLIARRSRK GFFAQI VLP AVFVCIALVF SLIVPPFGKY PSLELQPWMY NEQYTFVSND APEDTGTLEL LNALTKDPGF GTRCMEGNPI PDTPCQA GE EEWTTAPVPQ TIMDLFQNGN WTMQNPSPAC QCSSDKIKKM LPVCPPGAGG LPPPQRKQNT ADILQDLTGR NISDYLVK T YVQIIAKSLK NKIWVNEFRY GGFSLGVSNT QALPPSQEVN DAIKQMKKHL KLAKDSSADR FLNSLGRFMT GLDTKNNVK VWFNNKGWHA ISSFLNVINN AILRANLQKG ENPSHYGITA FNHPLNLTKQ QLSEVALMTT SVDVLVSICV IFAMSFVPAS FVVFLIQER VSKAKHLQFI SGVKPVIYWL SNFVWDMCNY VVPATLVIII FICFQQKSYV SSTNLPVLAL LLLLYGWSIT P LMYPASFV FKIPSTAYVV LTSVNLFIGI NGSVATFVLE LFTDNKLNNI NDILKSVFLI FPHFCLGRGL IDMVKNQAMA DA LERFGEN RFVSPLSWDL VGRNLFAMAV EGVVFFLITV LIQYRFFIRP RPVNAKLSPL NDEDEDVRRE RQRILDGGGQ NDI LEIKEL TKIYRRKRKP AVDRICVGIP PGECFGLLGV NGAGKSSTFK MLTGDTTVTR GDAFLNKNSI LSNIHEVHQN MGYC PQFDA ITELLTGREH VEFFALLRGV PEKEVGKVGE WAIRKLGLVK YGEKYAGNYS GGNKRKLSTA MALIGGPPVV FLDEP TTGM DPKARRFLWN CALSVVKEGR SVVLTSHSME ECEALCTRMA IMVNGRFRCL GSVQHLKNRF GDGYTIVVRI AGSNPD LKP VQDFFGLAFP GSVLKEKHRN MLQYQLPSSL SSLARIFSIL SQSKKRLHIE DYSVSQTTLD QVFVNFAKDQ SDDDHLK DL SLHKNQTVVD VAVLTSFLQD EKVKESYV UniProtKB: Phospholipid-transporting ATPase ABCA1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.8 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR | ||||||||||||
| 凍結 | 凍結剤: ETHANE | ||||||||||||
| 詳細 | Homogeneous, monodisperse sample of ABCA1 in nanodiscs |
- 電子顕微鏡法 #1
電子顕微鏡法 #1
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | FEI TITAN KRIOS |
| 撮影 | Image recording ID: 1 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 1.04 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 電子顕微鏡法 #1~
電子顕微鏡法 #1~
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | FEI TALOS ARCTICA |
| 撮影 | Image recording ID: 2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 1.07 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 36000 |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)