+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Xenopus KCNQ1-CaM in complex with ML277 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Activator / ion channel / TRANSPORT PROTEIN-ACTIVATOR complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of gastric acid secretion / membrane repolarization / delayed rectifier potassium channel activity / outward rectifier potassium channel activity / CaM pathway / intestinal absorption / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels ...regulation of gastric acid secretion / membrane repolarization / delayed rectifier potassium channel activity / outward rectifier potassium channel activity / CaM pathway / intestinal absorption / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / Activation of Ca-permeable Kainate Receptor / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation / CaMK IV-mediated phosphorylation of CREB / negative regulation of high voltage-gated calcium channel activity / Glycogen breakdown (glycogenolysis) / CLEC7A (Dectin-1) induces NFAT activation / Activation of RAC1 downstream of NMDARs / negative regulation of calcium ion export across plasma membrane / organelle localization by membrane tethering / mitochondrion-endoplasmic reticulum membrane tethering / autophagosome membrane docking / presynaptic endocytosis / renal absorption / regulation of cardiac muscle cell action potential / positive regulation of ryanodine-sensitive calcium-release channel activity / Synthesis of IP3 and IP4 in the cytosol / regulation of cell communication by electrical coupling involved in cardiac conduction / Phase 0 - rapid depolarisation / Negative regulation of NMDA receptor-mediated neuronal transmission / negative regulation of ryanodine-sensitive calcium-release channel activity / Unblocking of NMDA receptors, glutamate binding and activation / RHO GTPases activate PAKs / calcineurin-mediated signaling / inner ear development / Ion transport by P-type ATPases / Uptake and function of anthrax toxins / Long-term potentiation / Calcineurin activates NFAT / protein phosphatase activator activity / Regulation of MECP2 expression and activity / regulation of ryanodine-sensitive calcium-release channel activity / voltage-gated potassium channel activity / DARPP-32 events / monoatomic ion channel complex / Smooth Muscle Contraction / catalytic complex / detection of calcium ion / regulation of cardiac muscle contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / presynaptic cytosol / calcium channel inhibitor activity / cellular response to interferon-beta / Protein methylation / Activation of AMPK downstream of NMDARs / Ion homeostasis / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / eNOS activation / regulation of calcium-mediated signaling / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / titin binding / voltage-gated potassium channel complex / phosphatidylinositol-4,5-bisphosphate binding / potassium ion transmembrane transport / sperm midpiece / substantia nigra development / calcium channel complex / calyx of Held / FCERI mediated Ca+2 mobilization / Ras activation upon Ca2+ influx through NMDA receptor / FCGR3A-mediated IL10 synthesis / adenylate cyclase activator activity / regulation of heart rate / cytoplasmic vesicle membrane / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / protein serine/threonine kinase activator activity / VEGFR2 mediated cell proliferation / sarcomere / regulation of cytokinesis / VEGFR2 mediated vascular permeability / Translocation of SLC2A4 (GLUT4) to the plasma membrane / positive regulation of receptor signaling pathway via JAK-STAT / spindle microtubule / RAF activation / Transcriptional activation of mitochondrial biogenesis / Stimuli-sensing channels / cellular response to type II interferon / long-term synaptic potentiation / response to calcium ion / RAS processing / spindle pole / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / calcium-dependent protein binding / G2/M transition of mitotic cell cycle 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.9 Å | |||||||||
 データ登録者 データ登録者 | Willegems K / Kyriakis E | |||||||||
| 資金援助 | 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structural and electrophysiological basis for the modulation of KCNQ1 channel currents by ML277. 著者: Katrien Willegems / Jodene Eldstrom / Efthimios Kyriakis / Fariba Ataei / Harutyun Sahakyan / Ying Dou / Sophia Russo / Filip Van Petegem / David Fedida /   要旨: The KCNQ1 ion channel plays critical physiological roles in electrical excitability and K recycling in organs including the heart, brain, and gut. Loss of function is relatively common and can cause ...The KCNQ1 ion channel plays critical physiological roles in electrical excitability and K recycling in organs including the heart, brain, and gut. Loss of function is relatively common and can cause sudden arrhythmic death, sudden infant death, epilepsy and deafness. Here, we report cryogenic electron microscopic (cryo-EM) structures of Xenopus KCNQ1 bound to Ca/Calmodulin, with and without the KCNQ1 channel activator, ML277. A single binding site for ML277 was identified, localized to a pocket lined by the S4-S5 linker, S5 and S6 helices of two separate subunits. Several pocket residues are not conserved in other KCNQ isoforms, explaining specificity. MD simulations and point mutations support this binding location for ML277 in open and closed channels and reveal that prevention of inactivation is an important component of the activator effect. Our work provides direction for therapeutic intervention targeting KCNQ1 loss of function pathologies including long QT interval syndrome and seizures. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25813.map.gz emd_25813.map.gz | 167.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25813-v30.xml emd-25813-v30.xml emd-25813.xml emd-25813.xml | 17.8 KB 17.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_25813_fsc.xml emd_25813_fsc.xml | 16.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_25813.png emd_25813.png | 97.8 KB | ||
| Filedesc metadata |  emd-25813.cif.gz emd-25813.cif.gz | 6.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25813 http://ftp.pdbj.org/pub/emdb/structures/EMD-25813 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25813 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25813 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7tciMC  7tcpC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25813.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25813.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.835 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Potassium voltage-gated channel subfamily KQT member 1 in complex...
| 全体 | 名称: Potassium voltage-gated channel subfamily KQT member 1 in complex with calmodulin and ML277 |
|---|---|
| 要素 |
|
-超分子 #1: Potassium voltage-gated channel subfamily KQT member 1 in complex...
| 超分子 | 名称: Potassium voltage-gated channel subfamily KQT member 1 in complex with calmodulin and ML277 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 317.56 KDa |
-分子 #1: Potassium voltage-gated channel subfamily KQT member 1
| 分子 | 名称: Potassium voltage-gated channel subfamily KQT member 1 タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 62.663398 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MATDPPRPTI NLDPRVSIYS GRRPLLSRTN IQGRVYNFLE RPTGWKCFVY HFTVFLIVLI CLIFSVLSTI QQYNNLATET LFWMEIVLV VFFGAEYVVR LWSAGCRSKY VGVWGRLRFA RKPISVIDLI VVVASVIVLC VGSNGQVFAT SAIRGIRFLQ I LRMLHVDR ...文字列: MATDPPRPTI NLDPRVSIYS GRRPLLSRTN IQGRVYNFLE RPTGWKCFVY HFTVFLIVLI CLIFSVLSTI QQYNNLATET LFWMEIVLV VFFGAEYVVR LWSAGCRSKY VGVWGRLRFA RKPISVIDLI VVVASVIVLC VGSNGQVFAT SAIRGIRFLQ I LRMLHVDR QGGTWRLLGS VVFIHRQELI TTLYIGFLGL IFSSYFVYLA EKDAIDSSGE YQFGSYADAL WWGVVTVTTI GY GDKVPQT WIGKTIASCF SVFAISFFAL PAGILGSGFA LKVQQKQRQK HFNRQIPAAA SLIQTAWRCY AAENPDSATW KIY IRKQSR NHHLMSPSPK PKKSAMVKKK KIRTERDEGS TDKMLNIPHI TYDHVADDRK NDGYSVESYE NTVRKPFGFL DPST GPFIR TSSFTDDLDM EGDTLLTPIT HISELKEHHR AAIKVIRRMQ YFVAKKKFQQ ARKPYDVRDV IEQYSQGHLN LMVRI KELQ RRLDQSLGKP SLFLSVSDKV KDKGINTIGS RLNRVEDKVT QMDHKLNLIT DMLHHLLTNQ QSNS UniProtKB: Potassium voltage-gated channel subfamily KQT member 1 |
-分子 #2: Calmodulin-1
| 分子 | 名称: Calmodulin-1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 16.852545 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MADQLTEEQI AEFKEAFSLF DKDGDGTITT KELGTVMRSL GQNPTEAELQ DMINEVDADG NGTIDFPEFL TMMARKMKDT DSEEEIREA FRVFDKDGNG YISAAELRHV MTNLGEKLTD EEVDEMIREA DIDGDGQVNY EEFVQMMTAK UniProtKB: Calmodulin-1 |
-分子 #3: (2R)-N-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-1-(4-methylbenzene-...
| 分子 | 名称: (2R)-N-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-1-(4-methylbenzene-1-sulfonyl)piperidine-2-carboxamide タイプ: ligand / ID: 3 / コピー数: 4 / 式: I0S |
|---|---|
| 分子量 | 理論値: 471.592 Da |
| Chemical component information | 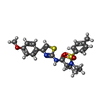 ChemComp-I0S: |
-分子 #4: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 4 / コピー数: 12 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.2 構成要素:
| |||||||||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 25 sec. / 前処理 - 雰囲気: AIR | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 98 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 4400 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 4.8 µm / 最小 デフォーカス(公称値): 0.53 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















