+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the periplasmic domain of GldM from Capnocytophaga canimorsus | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | type IX secretion system / MOTOR PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / : / GldM second domain / GldM third domain / Gliding motility-associated protein GldM / Gliding motility-associated protein GldM, C-terminal / Gliding motility-associated protein GldM, N-terminal / GldM C-terminal domain / GldM N-terminal domain 類似検索 - ドメイン・相同性 | |||||||||||||||
| 生物種 |  Capnocytophaga canimorsus Cc5 (バクテリア) / Capnocytophaga canimorsus Cc5 (バクテリア) /  Capnocytophaga canimorsus (strain 5) (バクテリア) Capnocytophaga canimorsus (strain 5) (バクテリア) | |||||||||||||||
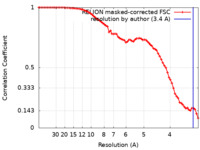
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||||||||
 データ登録者 データ登録者 | Hennell James R / Deme JC | |||||||||||||||
| 資金援助 | European Union, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: mBio / 年: 2022 ジャーナル: mBio / 年: 2022タイトル: Structures of the Type IX Secretion/Gliding Motility Motor from across the Phylum . 著者: Rory Hennell James / Justin C Deme / Alicia Hunter / Ben C Berks / Susan M Lea /   要旨: Gliding motility using cell surface adhesins, and export of proteins by the type IX secretion system (T9SS) are two phylum-specific features of the Bacteroidetes. Both of these processes are ...Gliding motility using cell surface adhesins, and export of proteins by the type IX secretion system (T9SS) are two phylum-specific features of the Bacteroidetes. Both of these processes are energized by the GldLM motor complex, which transduces the proton motive force at the inner membrane into mechanical work at the outer membrane. We previously used cryo-electron microscopy to solve the structure of the GldLM motor core from Flavobacterium johnsoniae at 3.9-Å resolution (R. Hennell James, J. C. Deme, A. Kjaer, F. Alcock, et al., Nat Microbiol 6:221-233, 2021, https://dx.doi.org/10.1038/s41564-020-00823-6). Here, we present structures of homologous complexes from a range of pathogenic and environmental species at up to 3.0-Å resolution. These structures show that the architecture of the GldLM motor core is conserved across the phylum, although there are species-specific differences at the N terminus of GldL. The resolution improvements reveal a cage-like structure that ties together the membrane-proximal cytoplasmic region of GldL and influences gliding function. These findings add detail to our structural understanding of bacterial ion-driven motors that drive the T9SS and gliding motility. Many bacteria in the phylum use the type IX secretion system to secrete proteins across their outer membrane. Most of these bacteria can also glide across surfaces using adhesin proteins that are propelled across the cell surface. Both secretion and gliding motility are driven by the GldLM protein complex, which forms a nanoscale electrochemical motor. We used cryo-electron microscopy to study the structure of the GldLM protein complex from different species, including the human pathogens Porphyromonas gingivalis and Capnocytophaga canimorsus. The organization of the motor is conserved across species, but we find species-specific structural differences and resolve motor features at higher resolution. This work improves our understanding of the type IX secretion system, which is a virulence determinant in human and animal diseases. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_24961.map.gz emd_24961.map.gz | 32 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-24961-v30.xml emd-24961-v30.xml emd-24961.xml emd-24961.xml | 20.1 KB 20.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_24961_fsc.xml emd_24961_fsc.xml | 7.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_24961.png emd_24961.png | 46.3 KB | ||
| マスクデータ |  emd_24961_msk_1.map emd_24961_msk_1.map | 34.3 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-24961.cif.gz emd-24961.cif.gz | 6.1 KB | ||
| その他 |  emd_24961_additional_1.map.gz emd_24961_additional_1.map.gz emd_24961_half_map_1.map.gz emd_24961_half_map_1.map.gz emd_24961_half_map_2.map.gz emd_24961_half_map_2.map.gz | 26.3 MB 26.4 MB 26.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-24961 http://ftp.pdbj.org/pub/emdb/structures/EMD-24961 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24961 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24961 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_24961_validation.pdf.gz emd_24961_validation.pdf.gz | 753.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_24961_full_validation.pdf.gz emd_24961_full_validation.pdf.gz | 753 KB | 表示 | |
| XML形式データ |  emd_24961_validation.xml.gz emd_24961_validation.xml.gz | 12.9 KB | 表示 | |
| CIF形式データ |  emd_24961_validation.cif.gz emd_24961_validation.cif.gz | 18 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24961 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24961 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24961 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24961 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_24961.map.gz / 形式: CCP4 / 大きさ: 34.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_24961.map.gz / 形式: CCP4 / 大きさ: 34.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.648 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_24961_msk_1.map emd_24961_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_24961_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_24961_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_24961_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Type IX Secretion System/gliding motility GldM periplasmic domain
| 全体 | 名称: Type IX Secretion System/gliding motility GldM periplasmic domain |
|---|---|
| 要素 |
|
-超分子 #1: Type IX Secretion System/gliding motility GldM periplasmic domain
| 超分子 | 名称: Type IX Secretion System/gliding motility GldM periplasmic domain タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: The structure of the periplasmic domain of GldM was solved using a sample that also included GldL and was used to solve a structure of GldLM |
|---|---|
| 由来(天然) | 生物種:  Capnocytophaga canimorsus Cc5 (バクテリア) Capnocytophaga canimorsus Cc5 (バクテリア) |
-分子 #1: GldM
| 分子 | 名称: GldM / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Capnocytophaga canimorsus (strain 5) (バクテリア) Capnocytophaga canimorsus (strain 5) (バクテリア) |
| 分子量 | 理論値: 41.123895 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAGGNSPRQK MINLMYLVFI SMLALNMGKE VLSAFGLMNE KLEASNEKAN NANINAIQAL EQNNAENPDQ FAEAFQKSKK VKELSDSFY NYIEGIKGEV MNQVGEDKKD YQVMDKSDYL DQKFFVGDNY KPEGEEFVRQ INDYKTQLVE LLGGKEGTYG E LVGKIDGN ...文字列: MAGGNSPRQK MINLMYLVFI SMLALNMGKE VLSAFGLMNE KLEASNEKAN NANINAIQAL EQNNAENPDQ FAEAFQKSKK VKELSDSFY NYIEGIKGEV MNQVGEDKKD YQVMDKSDYL DQKFFVGDNY KPEGEEFVRQ INDYKTQLVE LLGGKEGTYG E LVGKIDGN FNTNDVVDRE GVTRKWLNYN FEGFPYIASV AKLSMMQSDI RATEQEVYAE MLKGQLKSQI SMTNYTTLLE QS KGAYYQG ESFDGAIVLG RKDASTRPNE VELMLDGRKL SASEFQIEDG KVKLKVGAGN AGEHKITGNL YFDQDGKRIA VPV SQVFST IPKPENLYFQ GQFGSWSHPQ FEKGGGSGGG SGGGSWSHPQ FEK UniProtKB: Gliding motility protein GldM |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR / 詳細: 15 mA | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV / 詳細: Wait time 10 s Blot time 2 s. | |||||||||||||||
| 詳細 | The structure of the periplasmic domain of GldM was solved using a sample that also included GldL and was used to solve a structure of GldLM |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 59.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | A homology model based on the structure of FjoGldM (PDB 6EY4) was used as a starting model and modified to fit the EM density using Coot. Refinement was carried out using Phenix. |
|---|---|
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 93.02 |
| 得られたモデル |  PDB-7sb2: |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)