+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-24002 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM map of the FLP cargo within the T. maritima encapsulin | |||||||||
 マップデータ マップデータ | Symmetry expansion and local classification of one FLP cargo protein within the T. maritima encapsulin | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報encapsulin nanocompartment / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素 / iron ion transport / peptidase activity / intracellular iron ion homeostasis / proteolysis 類似検索 - 分子機能 | |||||||||
| 生物種 |   Thermotoga maritima (バクテリア) Thermotoga maritima (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.0 Å | |||||||||
 データ登録者 データ登録者 | LaFrance BJ / Savage DF / Nogales E | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Sci Rep / 年: 2021 ジャーナル: Sci Rep / 年: 2021タイトル: The encapsulin from Thermotoga maritima is a flavoprotein with a symmetry matched ferritin-like cargo protein. 著者: Benjamin J LaFrance / Caleb Cassidy-Amstutz / Robert J Nichols / Luke M Oltrogge / Eva Nogales / David F Savage /  要旨: Bacterial nanocompartments, also known as encapsulins, are an emerging class of protein-based 'organelles' found in bacteria and archaea. Encapsulins are virus-like icosahedral particles comprising a ...Bacterial nanocompartments, also known as encapsulins, are an emerging class of protein-based 'organelles' found in bacteria and archaea. Encapsulins are virus-like icosahedral particles comprising a ~ 25-50 nm shell surrounding a specific cargo enzyme. Compartmentalization is thought to create a unique chemical environment to facilitate catalysis and isolate toxic intermediates. Many questions regarding nanocompartment structure-function remain unanswered, including how shell symmetry dictates cargo loading and to what extent the shell facilitates enzymatic activity. Here, we explore these questions using the model Thermotoga maritima nanocompartment known to encapsulate a redox-active ferritin-like protein. Biochemical analysis revealed the encapsulin shell to possess a flavin binding site located at the interface between capsomere subunits, suggesting the shell may play a direct and active role in the function of the encapsulated cargo. Furthermore, we used cryo-EM to show that cargo proteins use a form of symmetry-matching to facilitate encapsulation and define stoichiometry. In the case of the Thermotoga maritima encapsulin, the decameric cargo protein with fivefold symmetry preferentially binds to the pentameric-axis of the icosahedral shell. Taken together, these observations suggest the shell is not simply a passive barrier-it also plays a significant role in the structure and function of the cargo enzyme. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_24002.map.gz emd_24002.map.gz | 37.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-24002-v30.xml emd-24002-v30.xml emd-24002.xml emd-24002.xml | 16.5 KB 16.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_24002.png emd_24002.png | 211.2 KB | ||
| その他 |  emd_24002_additional_1.map.gz emd_24002_additional_1.map.gz | 49.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-24002 http://ftp.pdbj.org/pub/emdb/structures/EMD-24002 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24002 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24002 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_24002_validation.pdf.gz emd_24002_validation.pdf.gz | 359.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_24002_full_validation.pdf.gz emd_24002_full_validation.pdf.gz | 359.1 KB | 表示 | |
| XML形式データ |  emd_24002_validation.xml.gz emd_24002_validation.xml.gz | 6.3 KB | 表示 | |
| CIF形式データ |  emd_24002_validation.cif.gz emd_24002_validation.cif.gz | 7.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24002 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24002 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24002 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24002 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_24002.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_24002.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Symmetry expansion and local classification of one FLP cargo protein within the T. maritima encapsulin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.64 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
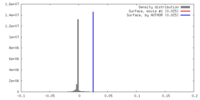
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: C1 reconstruction of T. maritima encapsulin showing all...
| ファイル | emd_24002_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | C1 reconstruction of T. maritima encapsulin showing all FLP cargo densities present in the shell | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
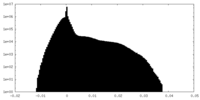
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM map of FLP cargo protein within the T. maritima encapsulin
| 全体 | 名称: Cryo-EM map of FLP cargo protein within the T. maritima encapsulin |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM map of FLP cargo protein within the T. maritima encapsulin
| 超分子 | 名称: Cryo-EM map of FLP cargo protein within the T. maritima encapsulin タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Thermotoga maritima (バクテリア) Thermotoga maritima (バクテリア) |
| 分子量 | 理論値: 1.83 MDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.0 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 20 mM Tris-HCl, pH 7.4, 150 mM NaCl and 5 mM 2-mercaptoethanol |
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV / 詳細: blot force. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / 撮影したグリッド数: 1 / 実像数: 1276 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.5 µm |
| 試料ステージ | 試料ホルダーモデル: GATAN 626 SINGLE TILT LIQUID NITROGEN CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| 詳細 | The homology model for the encapsulated FLP was created using Biozentrum's SWISS-MODEL, with 5DA5 as the reference structure. This was then rigid body docked into the FLP map using ChimeraX followed by PHENIX. The final model can be found in the supplementary materials of this manuscript at 'FLP-pentamer_model.py' |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT / 温度因子: 110 |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)