+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21432 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | bestrophin-2 Ca2+-bound state (5 mM Ca2+) | |||||||||||||||
 マップデータ マップデータ | bestrophin-2 (BEST2) calcium-bound state (5 mM Ca2+) | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Chloride Channel / MEMBRANE PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Stimuli-sensing channels / intracellularly ligand-gated monoatomic ion channel activity / ligand-gated monoatomic anion channel activity / bicarbonate channel activity / bicarbonate transport / ligand-gated monoatomic cation channel activity / chloride channel activity / chloride channel complex / basolateral plasma membrane / plasma membrane 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.36 Å | |||||||||||||||
 データ登録者 データ登録者 | Owji AP / Zhao Q | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2020 ジャーナル: Nat Struct Mol Biol / 年: 2020タイトル: Structural and functional characterization of the bestrophin-2 anion channel. 著者: Aaron P Owji / Qingqing Zhao / Changyi Ji / Alec Kittredge / Austin Hopiavuori / Ziao Fu / Nancy Ward / Oliver B Clarke / Yin Shen / Yu Zhang / Wayne A Hendrickson / Tingting Yang /   要旨: The bestrophin family of calcium (Ca)-activated chloride (Cl) channels, which mediate the influx and efflux of monovalent anions in response to the levels of intracellular Ca, comprises four members ...The bestrophin family of calcium (Ca)-activated chloride (Cl) channels, which mediate the influx and efflux of monovalent anions in response to the levels of intracellular Ca, comprises four members in mammals (bestrophin 1-4). Here we report cryo-EM structures of bovine bestrophin-2 (bBest2) bound and unbound by Ca at 2.4- and 2.2-Å resolution, respectively. The bBest2 structure highlights four previously underappreciated pore-lining residues specifically conserved in Best2 but not in Best1, illustrating the differences between these paralogs. Structure-inspired electrophysiological analysis reveals that, although the channel is sensitive to Ca, it has substantial Ca-independent activity for Cl, reflecting the opening at the cytoplasmic restriction of the ion conducting pathway even when Ca is absent. Moreover, the ion selectivity of bBest2 is controlled by multiple residues, including those involved in gating. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21432.map.gz emd_21432.map.gz | 95.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21432-v30.xml emd-21432-v30.xml emd-21432.xml emd-21432.xml | 17.9 KB 17.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_21432.png emd_21432.png | 79.8 KB | ||
| Filedesc metadata |  emd-21432.cif.gz emd-21432.cif.gz | 5.6 KB | ||
| その他 |  emd_21432_additional.map.gz emd_21432_additional.map.gz emd_21432_half_map_1.map.gz emd_21432_half_map_1.map.gz emd_21432_half_map_2.map.gz emd_21432_half_map_2.map.gz | 75.1 MB 139 MB 139 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21432 http://ftp.pdbj.org/pub/emdb/structures/EMD-21432 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21432 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21432 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_21432_validation.pdf.gz emd_21432_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_21432_full_validation.pdf.gz emd_21432_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_21432_validation.xml.gz emd_21432_validation.xml.gz | 15.1 KB | 表示 | |
| CIF形式データ |  emd_21432_validation.cif.gz emd_21432_validation.cif.gz | 17.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21432 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21432 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21432 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-21432 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21432.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21432.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | bestrophin-2 (BEST2) calcium-bound state (5 mM Ca2+) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.41499 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
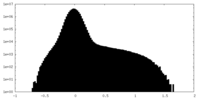
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: Additional map
| ファイル | emd_21432_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Additional map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
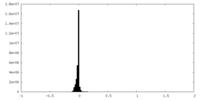
| 密度ヒストグラム |
-ハーフマップ: half-volume 1
| ファイル | emd_21432_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half-volume 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
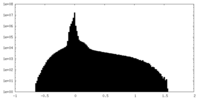
| 密度ヒストグラム |
-ハーフマップ: half-volume 2
| ファイル | emd_21432_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half-volume 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
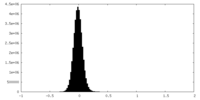
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : bestrophin-2 (BEST2) calcium-bound state (5 mM Ca2+)
| 全体 | 名称: bestrophin-2 (BEST2) calcium-bound state (5 mM Ca2+) |
|---|---|
| 要素 |
|
-超分子 #1: bestrophin-2 (BEST2) calcium-bound state (5 mM Ca2+)
| 超分子 | 名称: bestrophin-2 (BEST2) calcium-bound state (5 mM Ca2+) タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Bestrophin
| 分子 | 名称: Bestrophin / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 47.424754 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MTVTYTARVA KARFGGFSKL LLLWRGSIYK LLWRELLCFL GLFMALSAAY RFVLTEEQKR YFEKLVLYCD RYASLIPVSF VLGFYVTLV VHRWWNQYLS MPLTDALMCV VVGTVHGHDE RGRLYRRTLM RYAGLSGVLI LRSVSTAVFK RFPTIDHVVE A GFMTREER ...文字列: MTVTYTARVA KARFGGFSKL LLLWRGSIYK LLWRELLCFL GLFMALSAAY RFVLTEEQKR YFEKLVLYCD RYASLIPVSF VLGFYVTLV VHRWWNQYLS MPLTDALMCV VVGTVHGHDE RGRLYRRTLM RYAGLSGVLI LRSVSTAVFK RFPTIDHVVE A GFMTREER KKFENLNSSY NKYWVPCVWF CNLAAQARRE GRIRDNGAFK LLLEELNVFR SKCGMLFHYD WISVPLVYTQ VV TIAVYSY FLACLIGRQF LDPAQGYKDH DLDLCVPIFT LLQFFFYAGW LKVAEQLINP FGEDDDDFET NFLIDRCFQV SML AVDEMY DDLAMLEKDL YWDAAEARAP YTAATAFLMQ QPSFQGSTFD ITLAKEDMQF QRQDGLEAPL NEAHGDFLQR LLPV GTGMG TGGLL UniProtKB: Bestrophin-2 |
-分子 #2: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 2 / コピー数: 5 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-分子 #3: CHLORIDE ION
| 分子 | 名称: CHLORIDE ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: CL |
|---|---|
| 分子量 | 理論値: 35.453 Da |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 465 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.8 mg/mL |
|---|---|
| 緩衝液 | pH: 7.8 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 検出モード: COUNTING / 平均電子線量: 58.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C5 (5回回転対称) / 解像度のタイプ: BY AUTHOR / 解像度: 2.36 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC (ver. 2.13.2) / 使用した粒子像数: 332270 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) X (Row.)
X (Row.) Y (Col.)
Y (Col.)