+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2105 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Single particle electron microscopy of PilQ dodecameric complexes from Neisseria meningitidis. | |||||||||
 マップデータ マップデータ | Reconstruction of outer membrane protein complex PilQ. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Outer membrane protein / PilQ / pilus biogenesis | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報transport / establishment of competence for transformation / protein secretion / cell outer membrane / protein transport / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Neisseria meningitidis MC58 (髄膜炎菌) Neisseria meningitidis MC58 (髄膜炎菌) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / ネガティブ染色法 / 解像度: 26.0 Å | |||||||||
 データ登録者 データ登録者 | Berry JL / Phelan MM / Collins RF / Adomavicius T / Tonjum T / Frye S / Bird L / Owens R / Ford RC / Lian LY / Derrick JP | |||||||||
 引用 引用 |  ジャーナル: PLoS Pathog / 年: 2012 ジャーナル: PLoS Pathog / 年: 2012タイトル: Structure and assembly of a trans-periplasmic channel for type IV pili in Neisseria meningitidis. 著者: Jamie-Lee Berry / Marie M Phelan / Richard F Collins / Tomas Adomavicius / Tone Tønjum / Stefan A Frye / Louise Bird / Ray Owens / Robert C Ford / Lu-Yun Lian / Jeremy P Derrick /  要旨: Type IV pili are polymeric fibers which protrude from the cell surface and play a critical role in adhesion and invasion by pathogenic bacteria. The secretion of pili across the periplasm and outer ...Type IV pili are polymeric fibers which protrude from the cell surface and play a critical role in adhesion and invasion by pathogenic bacteria. The secretion of pili across the periplasm and outer membrane is mediated by a specialized secretin protein, PilQ, but the way in which this large channel is formed is unknown. Using NMR, we derived the structures of the periplasmic domains from N. meningitidis PilQ: the N-terminus is shown to consist of two β-domains, which are unique to the type IV pilus-dependent secretins. The structure of the second β-domain revealed an eight-stranded β-sandwich structure which is a novel variant of the HSP20-like fold. The central part of PilQ consists of two α/β fold domains: the structure of the first of these is similar to domains from other secretins, but with an additional α-helix which links it to the second α/β domain. We also determined the structure of the entire PilQ dodecamer by cryoelectron microscopy: it forms a cage-like structure, enclosing a cavity which is approximately 55 Å in internal diameter at its largest extent. Specific regions were identified in the density map which corresponded to the individual PilQ domains: this allowed us to dock them into the cryoelectron microscopy density map, and hence reconstruct the entire PilQ assembly which spans the periplasm. We also show that the C-terminal domain from the lipoprotein PilP, which is essential for pilus assembly, binds specifically to the first α/β domain in PilQ and use NMR chemical shift mapping to generate a model for the PilP:PilQ complex. We conclude that passage of the pilus fiber requires disassembly of both the membrane-spanning and the β-domain regions in PilQ, and that PilP plays an important role in stabilising the PilQ assembly during secretion, through its anchorage in the inner membrane. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2105.map.gz emd_2105.map.gz | 98.9 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2105-v30.xml emd-2105-v30.xml emd-2105.xml emd-2105.xml | 11.8 KB 11.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_2105.jpg emd_2105.jpg | 29.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2105 http://ftp.pdbj.org/pub/emdb/structures/EMD-2105 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2105 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2105 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2105_validation.pdf.gz emd_2105_validation.pdf.gz | 198.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2105_full_validation.pdf.gz emd_2105_full_validation.pdf.gz | 197.8 KB | 表示 | |
| XML形式データ |  emd_2105_validation.xml.gz emd_2105_validation.xml.gz | 4.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2105 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2105 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2105 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2105 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2105.map.gz / 形式: CCP4 / 大きさ: 1001 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2105.map.gz / 形式: CCP4 / 大きさ: 1001 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of outer membrane protein complex PilQ. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.53 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
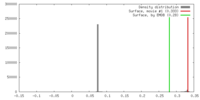
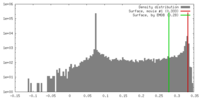
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Outer membrane protein PilQ from Neisseria meningitidis
| 全体 | 名称: Outer membrane protein PilQ from Neisseria meningitidis |
|---|---|
| 要素 |
|
-超分子 #1000: Outer membrane protein PilQ from Neisseria meningitidis
| 超分子 | 名称: Outer membrane protein PilQ from Neisseria meningitidis タイプ: sample / ID: 1000 / 詳細: Isolated from Neisserial membranes. / 集合状態: Dodecamer / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 960 KDa / 理論値: 960 KDa / 手法: From sequence |
-分子 #1: PilQ
| 分子 | 名称: PilQ / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 集合状態: Dodecamer / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  Neisseria meningitidis MC58 (髄膜炎菌) / 細胞中の位置: Outer membrane Neisseria meningitidis MC58 (髄膜炎菌) / 細胞中の位置: Outer membrane |
| 分子量 | 実験値: 960 KDa / 理論値: 960 KDa |
| 配列 | GO: transport, protein secretion, protein transport, establishment of competence for transformation, cell outer membrane, membrane InterPro: AMIN domain, GspD/PilQ family, NolW-like, Type IV pilus secretin PilQ, Secretin/TonB, short N-terminal domain, Type II/III secretion system, Type II secretion system protein GspD, conserved site |
-実験情報
-構造解析
| 手法 | ネガティブ染色法, クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 10 mM Tris-HCl, pH 7.5, 150 mM NaCl, 5 mM EDTA, and 0.1% (w/v) Zwittergent 3-10 |
| 染色 | タイプ: NEGATIVE 詳細: Unstained: Both sides of the grid were briefly blotted dry with Whatman No. 1 filter paper (2 x 1s blots) using a Vitrobot (FEI) device (90% relative humidity), and the grid was then ...詳細: Unstained: Both sides of the grid were briefly blotted dry with Whatman No. 1 filter paper (2 x 1s blots) using a Vitrobot (FEI) device (90% relative humidity), and the grid was then immediately plunged into liquid ethane maintained at <100K. |
| グリッド | 詳細: 400 mesh Quantifoil holey carbon grid with 1.2 micron diameter holes. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 100 K / 装置: FEI VITROBOT MARK III 手法: Both sides of the grid were briefly blotted dry with Whatman No. 1 filter paper in a humidity-controlled chamber using a Vitrobot (FEI) device (90% relative humidity), and the grid was then ...手法: Both sides of the grid were briefly blotted dry with Whatman No. 1 filter paper in a humidity-controlled chamber using a Vitrobot (FEI) device (90% relative humidity), and the grid was then plunged into liquid ethane maintained at <100K. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 温度 | 最低: 94 K / 最高: 100 K / 平均: 97 K |
| アライメント法 | Legacy - 非点収差: Via FFT |
| 日付 | 2007年11月27日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GENERIC GATAN (4k x 4k) 実像数: 55 / 平均電子線量: 4 e/Å2 / ビット/ピクセル: 8 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 33112 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 5.1 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 33000 |
| 試料ステージ | 試料ホルダー: Liquid nitrogen cooled / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | 29000 |
|---|---|
| CTF補正 | 詳細: CTFFIT each micrograph |
| 最終 再構成 | 想定した対称性 - 点群: C12 (12回回転対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 26.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: EMAN 詳細: Two different starting models were employed with convergence between them. This map was generated from model 1. 使用した粒子像数: 25303 |
| 最終 2次元分類 | クラス数: 101 |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) X (Row.)
X (Row.) Y (Col.)
Y (Col.)