+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20842 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Endophilin B1 helical scaffold | |||||||||
 マップデータ マップデータ | Helical assembly of endophilin B1_N-BAR | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Membrane binding / amphipathic helix / BAR protein / SH3 domain / membrane trafficking / cell death / CYTOSOLIC PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of membrane tubulation / autophagic cell death / protein localization to vacuolar membrane / positive regulation of autophagosome assembly / receptor catabolic process / membrane fission / membrane organization / positive regulation of protein targeting to mitochondrion / autophagosome membrane / regulation of macroautophagy ...positive regulation of membrane tubulation / autophagic cell death / protein localization to vacuolar membrane / positive regulation of autophagosome assembly / receptor catabolic process / membrane fission / membrane organization / positive regulation of protein targeting to mitochondrion / autophagosome membrane / regulation of macroautophagy / positive regulation of autophagy / cellular response to glucose starvation / cellular response to amino acid starvation / regulation of cytokinesis / positive regulation of protein-containing complex assembly / regulation of protein stability / autophagy / midbody / cytoplasmic vesicle / mitochondrial outer membrane / cadherin binding / Golgi membrane / lipid binding / apoptotic process / protein homodimerization activity / protein-containing complex / identical protein binding / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 10.0 Å | |||||||||
 データ登録者 データ登録者 | Bhatt VS / Sundborger-Lunna AC | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2021 ジャーナル: Structure / 年: 2021タイトル: Amphipathic Motifs Regulate N-BAR Protein Endophilin B1 Auto-inhibition and Drive Membrane Remodeling. 著者: Veer S Bhatt / Robert Ashley / Anna Sundborger-Lunna /  要旨: Membrane remodeling is a common theme in a variety of cellular processes. Here, we investigated membrane remodeling N-BAR protein endophilin B1, a critical player in diverse intracellular trafficking ...Membrane remodeling is a common theme in a variety of cellular processes. Here, we investigated membrane remodeling N-BAR protein endophilin B1, a critical player in diverse intracellular trafficking events, including mitochondrial and Golgi fission, and apoptosis. We find that endophilin B1 assembles into helical scaffolds on membranes, and that both membrane binding and assembly are driven by interactions between N-terminal helix H0 and the lipid bilayer. Furthermore, we find that endophilin B1 membrane remodeling is auto-inhibited and identify direct SH3 domain-H0 interactions as the underlying mechanism. Our results indicate that lipid composition plays a role in dictating endophilin B1 activity. Taken together, this study provides insight into a poorly understood N-BAR protein family member and highlights molecular mechanisms that may be general for the regulation of membrane remodeling. Our work suggests that interplay between membrane lipids and membrane interacting proteins facilitates spatial and temporal coordination of membrane remodeling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20842.map.gz emd_20842.map.gz | 35.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20842-v30.xml emd-20842-v30.xml emd-20842.xml emd-20842.xml | 9.3 KB 9.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_20842.png emd_20842.png | 55.3 KB | ||
| Filedesc metadata |  emd-20842.cif.gz emd-20842.cif.gz | 5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20842 http://ftp.pdbj.org/pub/emdb/structures/EMD-20842 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20842 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20842 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_20842_validation.pdf.gz emd_20842_validation.pdf.gz | 430.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_20842_full_validation.pdf.gz emd_20842_full_validation.pdf.gz | 430.4 KB | 表示 | |
| XML形式データ |  emd_20842_validation.xml.gz emd_20842_validation.xml.gz | 6.1 KB | 表示 | |
| CIF形式データ |  emd_20842_validation.cif.gz emd_20842_validation.cif.gz | 6.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20842 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20842 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20842 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20842 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20842.map.gz / 形式: CCP4 / 大きさ: 37.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20842.map.gz / 形式: CCP4 / 大きさ: 37.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Helical assembly of endophilin B1_N-BAR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.2942 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
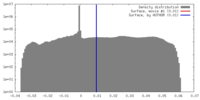
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Endophilin B1 helical assembly
| 全体 | 名称: Endophilin B1 helical assembly |
|---|---|
| 要素 |
|
-超分子 #1: Endophilin B1 helical assembly
| 超分子 | 名称: Endophilin B1 helical assembly / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: Endohilin B1 N-BAR domain |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Endophilin-B1
| 分子 | 名称: Endophilin-B1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 48 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 40.843246 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MNIMDFNVKK LAADAGTFLS RAVQFTEEKL GQAEKTELDA HLENLLSKAE CTKIWTEKIM KQTEVLLQPN PNARIEEFVY EKLDRKAPS RINNPELLGQ YMIDAGTEFG PGTAYGNALI KCGETQKRIG TADRELIQTS ALNFLTPLRN FIEGDYKTIA K ERKLLQNK ...文字列: MNIMDFNVKK LAADAGTFLS RAVQFTEEKL GQAEKTELDA HLENLLSKAE CTKIWTEKIM KQTEVLLQPN PNARIEEFVY EKLDRKAPS RINNPELLGQ YMIDAGTEFG PGTAYGNALI KCGETQKRIG TADRELIQTS ALNFLTPLRN FIEGDYKTIA K ERKLLQNK RLDLDAAKTR LKKAKAAETR NSSEQELRIT QSEFDRQAEI TRLLLEGISS THAHHLRCLN DFVEAQMTYY AQ CYQYMLD LQKQLGSFPS NYLSNNNQTS VTPVPSVLPN AIGSSAMAST SGLVITSPSN LSDLKECSGS RKARVLYDYD AAN STELSL LADEVITVFS VVGMDSDWLM GERGNQKGKV PITYLELLN UniProtKB: Endophilin-B1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 8.1 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: OTHER / 平均電子線量: 30.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 17.8 Å 想定した対称性 - らせんパラメータ - ΔΦ: 59.1 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 10.0 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 21197 |
|---|---|
| 初期モデル | モデルのタイプ: OTHER / 詳細: Featureless cylinder |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)