+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20227 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Dataset II: Sub-3 Angstrom Apoferritin Structure Determined With Full Range of Phase Shifts Using A Single Position Of Volta Phase Plate | |||||||||
 マップデータ マップデータ | em-volume_P1 | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.85 Å | |||||||||
 データ登録者 データ登録者 | Li K / Sun C / Klose T / Irimia-Dominguez J / Vago FS / Vidal R / Jiang W | |||||||||
 引用 引用 |  ジャーナル: J Struct Biol / 年: 2019 ジャーナル: J Struct Biol / 年: 2019タイトル: Sub-3 Å apoferritin structure determined with full range of phase shifts using a single position of volta phase plate. 著者: Kunpeng Li / Chen Sun / Thomas Klose / Jose Irimia-Dominguez / Frank S Vago / Ruben Vidal / Wen Jiang /  要旨: Volta Phase Plate (VPP) has become an invaluable tool for cryo-EM structural determination of small protein complexes by increasing image contrast. Currently, the standard protocol of VPP usage ...Volta Phase Plate (VPP) has become an invaluable tool for cryo-EM structural determination of small protein complexes by increasing image contrast. Currently, the standard protocol of VPP usage periodically changes the VPP position to a fresh spot during data collection. Such a protocol was to target the phase shifts to a relatively narrow range (around 90°) based on the observations of increased phase shifts and image blur associated with more images taken with a single VPP position. Here, we report a 2.87 Å resolution structure of apoferritin reconstructed from a dataset collected using only a single position of VPP. The reconstruction resolution and map density features are nearly identical to the reconstruction from the control dataset collected with periodic change of VPP positions. Further experiments have verified that similar results, including a 2.5 Å resolution structure, could be obtained with a full range of phase shifts, different spots of variable phase shift increasing rates, and at different ages of the VPP post-installation. Furthermore, we have found that the phase shifts at low resolutions, probably related to the finite size of the Volta spots, could not be correctly modeled by current CTF model using a constant phase shift at all frequencies. In dataset III, severe beam tilt issue was identified but could be computationally corrected with iterative refinements. The observations in this study may provide new insights into further improvement of both the efficiency and robustness of VPP, and to help turn VPP into a plug-and-play device for high-resolution cryo-EM. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20227.map.gz emd_20227.map.gz | 92.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20227-v30.xml emd-20227-v30.xml emd-20227.xml emd-20227.xml | 13.2 KB 13.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_20227_fsc.xml emd_20227_fsc.xml | 12.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_20227.png emd_20227.png | 238.7 KB | ||
| マスクデータ |  emd_20227_msk_1.map emd_20227_msk_1.map emd_20227_msk_2.map emd_20227_msk_2.map | 178 MB 178 MB |  マスクマップ マスクマップ | |
| その他 |  emd_20227_half_map_1.map.gz emd_20227_half_map_1.map.gz emd_20227_half_map_2.map.gz emd_20227_half_map_2.map.gz | 92.8 MB 92.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20227 http://ftp.pdbj.org/pub/emdb/structures/EMD-20227 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20227 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20227 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_20227_validation.pdf.gz emd_20227_validation.pdf.gz | 78.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_20227_full_validation.pdf.gz emd_20227_full_validation.pdf.gz | 77.9 KB | 表示 | |
| XML形式データ |  emd_20227_validation.xml.gz emd_20227_validation.xml.gz | 495 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20227 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20227 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20227 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20227 | HTTPS FTP |
-関連構造データ
| 関連構造データ | C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10263 (タイトル: Sub-3 Å Apoferritin Structure Determined With Full Range of Phase Shifts Using A Single Position Of Volta Phase Plate EMPIAR-10263 (タイトル: Sub-3 Å Apoferritin Structure Determined With Full Range of Phase Shifts Using A Single Position Of Volta Phase PlateData size: 778.8 Data #1: Unaligned multi-frame movie of apoferritin Dataset I [micrographs - multiframe] Data #2: Unaligned multi-frame movie of apoferritin Dataset II [micrographs - multiframe] Data #3: Unaligned multi-frame movie of apoferritin Dataset III [micrographs - multiframe] Data #4: Unaligned multi-frame movie of apoferritin Dataset IV [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20227.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20227.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | em-volume_P1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.658 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
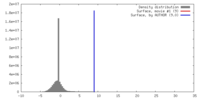
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_20227_msk_1.map emd_20227_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
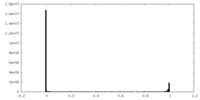
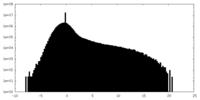
| 密度ヒストグラム |
-マスク #2
| ファイル |  emd_20227_msk_2.map emd_20227_msk_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
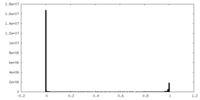
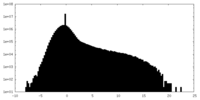
| 密度ヒストグラム |
-ハーフマップ: em-half-volume P1
| ファイル | emd_20227_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | em-half-volume_P1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
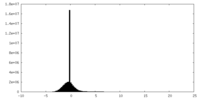
| 密度ヒストグラム |
-ハーフマップ: em-half-volume P2
| ファイル | emd_20227_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | em-half-volume_P2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human Apoferritin light chain
| 全体 | 名称: Human Apoferritin light chain |
|---|---|
| 要素 |
|
-超分子 #1: Human Apoferritin light chain
| 超分子 | 名称: Human Apoferritin light chain / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 440 KDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 35.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: |
|---|
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)