| 登録情報 | データベース: EMDB / ID: EMD-20092
|
|---|
| タイトル | Monomeric kinesin-1 motor domain in no-nucleotide state bound to GMPCPP-stabilized microtubule |
|---|
 マップデータ マップデータ | Monomeric kinesin-1 motor domain in the no-nucleotide state bound to GMPCPP-stabilized microtubule |
|---|
 試料 試料 | - 複合体: Monomeric kinesin-1 motor domain in the no-nucleotide state bound to GMPCPP-stabilized microtubules
- タンパク質・ペプチド: Tubulin beta-2B chain
- タンパク質・ペプチド: Tubulin alpha-1B chain
- タンパク質・ペプチド: Kinesin-1 heavy chain
- リガンド: PHOSPHOMETHYLPHOSPHONIC ACID GUANYLATE ESTER
- リガンド: MAGNESIUM ION
- リガンド: GUANOSINE-5'-TRIPHOSPHATE
|
|---|
 キーワード キーワード | Kinesin / Microtubule / MOTOR PROTEIN |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
regulation of modification of synapse structure, modulating synaptic transmission / plus-end-directed vesicle transport along microtubule / cytoplasm organization / cytolytic granule membrane / anterograde dendritic transport of neurotransmitter receptor complex / anterograde neuronal dense core vesicle transport / mitocytosis / retrograde neuronal dense core vesicle transport / anterograde axonal protein transport / ciliary rootlet ...regulation of modification of synapse structure, modulating synaptic transmission / plus-end-directed vesicle transport along microtubule / cytoplasm organization / cytolytic granule membrane / anterograde dendritic transport of neurotransmitter receptor complex / anterograde neuronal dense core vesicle transport / mitocytosis / retrograde neuronal dense core vesicle transport / anterograde axonal protein transport / ciliary rootlet / lysosome localization / positive regulation of potassium ion transport / plus-end-directed microtubule motor activity / vesicle transport along microtubule / RHO GTPases activate KTN1 / Kinesins / positive regulation of axon guidance / kinesin complex / microtubule motor activity / centrosome localization / mitochondrion transport along microtubule / COPI-dependent Golgi-to-ER retrograde traffic / microtubule-based movement / stress granule disassembly / natural killer cell mediated cytotoxicity / Insulin processing / synaptic vesicle transport / postsynaptic cytosol / microtubule-based process / cytoplasmic microtubule / phagocytic vesicle / axon cytoplasm / MHC class II antigen presentation / cellular response to interleukin-4 / dendrite cytoplasm / axon guidance / positive regulation of synaptic transmission, GABAergic / regulation of membrane potential / positive regulation of protein localization to plasma membrane / cellular response to type II interferon / structural constituent of cytoskeleton / centriolar satellite / microtubule cytoskeleton organization / neuron migration / Signaling by ALK fusions and activated point mutants / mitotic cell cycle / double-stranded RNA binding / microtubule cytoskeleton / nuclear membrane / microtubule binding / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / vesicle / microtubule / cilium / cadherin binding / protein heterodimerization activity / GTPase activity / ubiquitin protein ligase binding / GTP binding / protein-containing complex binding / perinuclear region of cytoplasm / ATP hydrolysis activity / mitochondrion / ATP binding / metal ion binding / identical protein binding / membrane / cytoplasm / cytosol類似検索 - 分子機能 Kinesin-like protein / Kinesin motor domain signature. / Kinesin motor domain, conserved site / Kinesin motor domain / Kinesin motor domain profile. / Kinesin motor, catalytic domain. ATPase. / Kinesin motor domain / Kinesin motor domain superfamily / Alpha tubulin / Tubulin-beta mRNA autoregulation signal. ...Kinesin-like protein / Kinesin motor domain signature. / Kinesin motor domain, conserved site / Kinesin motor domain / Kinesin motor domain profile. / Kinesin motor, catalytic domain. ATPase. / Kinesin motor domain / Kinesin motor domain superfamily / Alpha tubulin / Tubulin-beta mRNA autoregulation signal. / Beta tubulin, autoregulation binding site / Beta tubulin / Tubulin / Tubulin, C-terminal / Tubulin C-terminal domain / Tubulin, conserved site / Tubulin subunits alpha, beta, and gamma signature. / Tubulin/FtsZ family, C-terminal domain / Tubulin/FtsZ-like, C-terminal domain / Tubulin/FtsZ, C-terminal / Tubulin/FtsZ, 2-layer sandwich domain / Tubulin/FtsZ family, GTPase domain / Tubulin/FtsZ family, GTPase domain / Tubulin/FtsZ, GTPase domain / Tubulin/FtsZ, GTPase domain superfamily / P-loop containing nucleoside triphosphate hydrolase類似検索 - ドメイン・相同性 Kinesin-1 heavy chain / Tubulin alpha-1B chain / Tubulin beta-2B chain類似検索 - 構成要素 |
|---|
| 生物種 |   Bos taurus (ウシ) / Bos taurus (ウシ) /  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.67 Å |
|---|
 データ登録者 データ登録者 | Cha HK / Debs G |
|---|
| 資金援助 |  米国, 1件 米国, 1件 | Organization | Grant number | 国 |
|---|
| National Institutes of Health/National Human Genome Research Institute (NIH/NHGRI) | R01 GM 110530-01 |  米国 米国 |
|
|---|
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Published
タイトル: Structural Intermediates of the Dimeric Kinesin Stepping Cycle Revealed by Cryo-EM
著者: Cha HK / Debs G / Liu X / Liu D / Sindelar CV |
|---|
| 履歴 | | 登録 | 2019年4月12日 | - |
|---|
| ヘッダ(付随情報) 公開 | 2019年8月21日 | - |
|---|
| マップ公開 | 2020年4月15日 | - |
|---|
| 更新 | 2024年3月20日 | - |
|---|
| 現状 | 2024年3月20日 | 処理サイト: RCSB / 状態: 公開 |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 ムービービューア
ムービービューア SurfView
SurfView Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク emd_20092.map.gz
emd_20092.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-20092-v30.xml
emd-20092-v30.xml emd-20092.xml
emd-20092.xml EMDBヘッダ
EMDBヘッダ emd_20092.png
emd_20092.png emd-20092.cif.gz
emd-20092.cif.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-20092
http://ftp.pdbj.org/pub/emdb/structures/EMD-20092 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20092
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20092 emd_20092_validation.pdf.gz
emd_20092_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_20092_full_validation.pdf.gz
emd_20092_full_validation.pdf.gz emd_20092_validation.xml.gz
emd_20092_validation.xml.gz emd_20092_validation.cif.gz
emd_20092_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20092
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20092 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20092
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20092 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
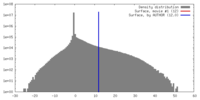
マップ ダウンロード / ファイル: emd_20092.map.gz / 形式: CCP4 / 大きさ: 371.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_20092.map.gz / 形式: CCP4 / 大きさ: 371.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素


 Homo sapiens (ヒト)
Homo sapiens (ヒト)

 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析 ムービー
ムービー コントローラー
コントローラー



































 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)