+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Escherichia coli paused disome complex (local refinement of leading 70S open non-rotated PRE) | |||||||||
 マップデータ マップデータ | Cryo-EM reconstruction of the E. coli disome complex (local refinement of leading 70S open non-rotated PRE). Full map. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ribosome / polysome / tranlsation / elongation / pausing / disome / collision / PURE system | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.79 Å | |||||||||
 データ登録者 データ登録者 | Fluegel T / Schacherl M | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Transient disome complex formation in native polysomes during ongoing protein synthesis captured by cryo-EM. 著者: Timo Flügel / Magdalena Schacherl / Anett Unbehaun / Birgit Schroeer / Marylena Dabrowski / Jörg Bürger / Thorsten Mielke / Thiemo Sprink / Christoph A Diebolder / Yollete V Guillén ...著者: Timo Flügel / Magdalena Schacherl / Anett Unbehaun / Birgit Schroeer / Marylena Dabrowski / Jörg Bürger / Thorsten Mielke / Thiemo Sprink / Christoph A Diebolder / Yollete V Guillén Schlippe / Christian M T Spahn /  要旨: Structural studies of translating ribosomes traditionally rely on in vitro assembly and stalling of ribosomes in defined states. To comprehensively visualize bacterial translation, we reactivated ex ...Structural studies of translating ribosomes traditionally rely on in vitro assembly and stalling of ribosomes in defined states. To comprehensively visualize bacterial translation, we reactivated ex vivo-derived E. coli polysomes in the PURE in vitro translation system and analyzed the actively elongating polysomes by cryo-EM. We find that 31% of 70S ribosomes assemble into disome complexes that represent eight distinct functional states including decoding and termination intermediates, and a pre-nucleophilic attack state. The functional diversity of disome complexes together with RNase digest experiments suggests that paused disome complexes transiently form during ongoing elongation. Structural analysis revealed five disome interfaces between leading and queueing ribosomes that undergo rearrangements as the leading ribosome traverses through the elongation cycle. Our findings reveal at the molecular level how bL9's CTD obstructs the factor binding site of queueing ribosomes to thwart harmful collisions and illustrate how translation dynamics reshape inter-ribosomal contacts. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_19098.map.gz emd_19098.map.gz | 186.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-19098-v30.xml emd-19098-v30.xml emd-19098.xml emd-19098.xml | 25.6 KB 25.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
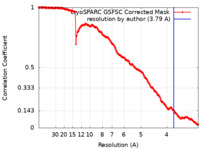
| FSC (解像度算出) |  emd_19098_fsc.xml emd_19098_fsc.xml | 15.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_19098.png emd_19098.png | 54.8 KB | ||
| マスクデータ |  emd_19098_msk_1.map emd_19098_msk_1.map | 391 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-19098.cif.gz emd-19098.cif.gz | 5.3 KB | ||
| その他 |  emd_19098_half_map_1.map.gz emd_19098_half_map_1.map.gz emd_19098_half_map_2.map.gz emd_19098_half_map_2.map.gz | 362.3 MB 362.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-19098 http://ftp.pdbj.org/pub/emdb/structures/EMD-19098 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19098 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-19098 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_19098_validation.pdf.gz emd_19098_validation.pdf.gz | 1.3 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_19098_full_validation.pdf.gz emd_19098_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  emd_19098_validation.xml.gz emd_19098_validation.xml.gz | 25.1 KB | 表示 | |
| CIF形式データ |  emd_19098_validation.cif.gz emd_19098_validation.cif.gz | 33 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19098 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19098 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19098 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-19098 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_19098.map.gz / 形式: CCP4 / 大きさ: 391 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_19098.map.gz / 形式: CCP4 / 大きさ: 391 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of the E. coli disome complex (local refinement of leading 70S open non-rotated PRE). Full map. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.59 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_19098_msk_1.map emd_19098_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM reconstruction of the E. coli disome complex...
| ファイル | emd_19098_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of the E. coli disome complex (local refinement of leading 70S open non-rotated PRE). Half map A. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Cryo-EM reconstruction of the E. coli disome complex...
| ファイル | emd_19098_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of the E. coli disome complex (local refinement of leading 70S open non-rotated PRE). Half map B. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Escherichia coli paused disome complex
| 全体 | 名称: Escherichia coli paused disome complex |
|---|---|
| 要素 |
|
-超分子 #1: Escherichia coli paused disome complex
| 超分子 | 名称: Escherichia coli paused disome complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#33, #35-#60 |
|---|---|
| 由来(天然) | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.6 |
|---|---|
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 75 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: Withdrawn samples were spotted directly onto freshly glow-discharged holey carbon grids, blotted for 1-2 s, and flash frozen in liquid ethane using a Vitrobot Mark IV plunger (ThermoFisher ...詳細: Withdrawn samples were spotted directly onto freshly glow-discharged holey carbon grids, blotted for 1-2 s, and flash frozen in liquid ethane using a Vitrobot Mark IV plunger (ThermoFisher Scientific) after a wait time of 40 s at 4 degrees Celcius.. |
| 詳細 | In vitro translation reactions were performed in the PURE translation system using the PURExpress delta ribosome kit (NEB, #E3313S). Translation reactions were supplemented with 0.8 U/uL RNAsin Plus RNase Inhibitor (Promega, N261B). SolA, factor mix, and RNAsin Plus were combined on ice, followed by a preincubation at 37 degrees Celcius for 2 min, and added directly to polysomes (700 nM final concentration) that had been preincubated at 37 degrees Celsius for 2 min. After 1 min reaction time, 4 uL of the reaction mixture were withdrawn for plunge freezing. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 80.0 K / 最高: 82.0 K |
| ソフトウェア | 名称: EPU (ver. 2.8.1) |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 8982 / 平均露光時間: 1.13 sec. / 平均電子線量: 45.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| ソフトウェア | 名称:  Coot (ver. 0.9.6) Coot (ver. 0.9.6) |
| 詳細 | The atomic model of the E. coli 70S ribosome (PDB ID: 7N1P) was initially docked into the postprocessed density maps with UCSF Chimera and manually adjusted in Coot. All models were refined over multiple rounds using the module phenix.real_space_refine in PHENIX and interactive model building and refinement in Coot, using libG restraints for the RNAs. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT 当てはまり具合の基準: Cross-correlation coefficient |
 ムービー
ムービー コントローラー
コントローラー



















































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)