+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
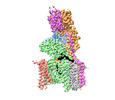
| タイトル | Structure of human oligosaccharyltransferase OST-A complex bound to NGI-1 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | N-glycosylation / OST-A complex / NGI-1 inhibitor / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報oligosaccharyltransferase complex binding / oligosaccharyltransferase complex A / oligosaccharyltransferase complex B / Asparagine N-linked glycosylation / dolichyl-diphosphooligosaccharide-protein glycotransferase / dolichyl-diphosphooligosaccharide-protein glycotransferase activity / oligosaccharyltransferase complex / : / : / protein N-linked glycosylation ...oligosaccharyltransferase complex binding / oligosaccharyltransferase complex A / oligosaccharyltransferase complex B / Asparagine N-linked glycosylation / dolichyl-diphosphooligosaccharide-protein glycotransferase / dolichyl-diphosphooligosaccharide-protein glycotransferase activity / oligosaccharyltransferase complex / : / : / protein N-linked glycosylation / epithelial cell apoptotic process / azurophil granule membrane / : / Advanced glycosylation endproduct receptor signaling / blastocyst development / SRP-dependent cotranslational protein targeting to membrane / rough endoplasmic reticulum / response to cytokine / post-translational protein modification / response to endoplasmic reticulum stress / T cell activation / enzyme activator activity / regulation of protein stability / protein modification process / melanosome / protein-macromolecule adaptor activity / Maturation of spike protein / nuclear body / inflammatory response / intracellular membrane-bounded organelle / apoptotic process / Neutrophil degranulation / endoplasmic reticulum membrane / negative regulation of apoptotic process / endoplasmic reticulum / RNA binding / metal ion binding / membrane / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.61 Å | |||||||||
 データ登録者 データ登録者 | Ramirez AS / Kowal J / Locher KP | |||||||||
| 資金援助 |  スイス, 1件 スイス, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2024 ジャーナル: Cell / 年: 2024タイトル: Positive selection CRISPR screens reveal a druggable pocket in an oligosaccharyltransferase required for inflammatory signaling to NF-κB. 著者: Benjamin L Lampson / Ana S Ramίrez / Marta Baro / Lixia He / Mudra Hegde / Vidyasagar Koduri / Jamie L Pfaff / Ruth E Hanna / Julia Kowal / Nitin H Shirole / Yanfeng He / John G Doench / ...著者: Benjamin L Lampson / Ana S Ramίrez / Marta Baro / Lixia He / Mudra Hegde / Vidyasagar Koduri / Jamie L Pfaff / Ruth E Hanna / Julia Kowal / Nitin H Shirole / Yanfeng He / John G Doench / Joseph N Contessa / Kaspar P Locher / William G Kaelin /   要旨: Nuclear factor κB (NF-κB) plays roles in various diseases. Many inflammatory signals, such as circulating lipopolysaccharides (LPSs), activate NF-κB via specific receptors. Using whole-genome ...Nuclear factor κB (NF-κB) plays roles in various diseases. Many inflammatory signals, such as circulating lipopolysaccharides (LPSs), activate NF-κB via specific receptors. Using whole-genome CRISPR-Cas9 screens of LPS-treated cells that express an NF-κB-driven suicide gene, we discovered that the LPS receptor Toll-like receptor 4 (TLR4) is specifically dependent on the oligosaccharyltransferase complex OST-A for N-glycosylation and cell-surface localization. The tool compound NGI-1 inhibits OST complexes in vivo, but the underlying molecular mechanism remained unknown. We did a CRISPR base-editor screen for NGI-1-resistant variants of STT3A, the catalytic subunit of OST-A. These variants, in conjunction with cryoelectron microscopy studies, revealed that NGI-1 binds the catalytic site of STT3A, where it traps a molecule of the donor substrate dolichyl-PP-GlcNAc-Man-Glc, suggesting an uncompetitive inhibition mechanism. Our results provide a rationale for and an initial step toward the development of STT3A-specific inhibitors and illustrate the power of contemporaneous base-editor and structural studies to define drug mechanism of action. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_17779.map.gz emd_17779.map.gz | 483.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-17779-v30.xml emd-17779-v30.xml emd-17779.xml emd-17779.xml | 25.8 KB 25.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_17779.png emd_17779.png | 86.8 KB | ||
| Filedesc metadata |  emd-17779.cif.gz emd-17779.cif.gz | 8.6 KB | ||
| その他 |  emd_17779_half_map_1.map.gz emd_17779_half_map_1.map.gz emd_17779_half_map_2.map.gz emd_17779_half_map_2.map.gz | 475.7 MB 475.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-17779 http://ftp.pdbj.org/pub/emdb/structures/EMD-17779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17779 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17779 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_17779_validation.pdf.gz emd_17779_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_17779_full_validation.pdf.gz emd_17779_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_17779_validation.xml.gz emd_17779_validation.xml.gz | 18.5 KB | 表示 | |
| CIF形式データ |  emd_17779_validation.cif.gz emd_17779_validation.cif.gz | 21.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17779 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17779 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17779 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-17779 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8pn9MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_17779.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_17779.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.648 Å | ||||||||||||||||||||||||||||||||||||
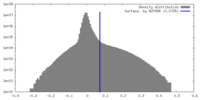
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_17779_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
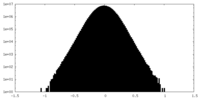
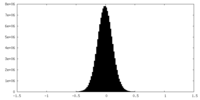
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_17779_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
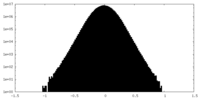
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : OLIGOSACCHARYLTRANSFERASE COMPLEX OST-A WITH BOUND NGI-1 INHIBITOR
+超分子 #1: OLIGOSACCHARYLTRANSFERASE COMPLEX OST-A WITH BOUND NGI-1 INHIBITOR
+分子 #1: Dolichyl-diphosphooligosaccharide--protein glycosyltransferase su...
+分子 #2: Dolichyl-diphosphooligosaccharide--protein glycosyltransferase su...
+分子 #3: Transmembrane protein 258
+分子 #4: Dolichyl-diphosphooligosaccharide--protein glycosyltransferase su...
+分子 #5: Dolichyl-diphosphooligosaccharide--protein glycosyltransferase su...
+分子 #6: Dolichyl-diphosphooligosaccharide--protein glycosyltransferase su...
+分子 #7: Oligosaccharyltransferase complex subunit OSTC
+分子 #8: Dolichyl-diphosphooligosaccharide--protein glycosyltransferase 48...
+分子 #13: (2~{S},3~{R},4~{R},5~{S},6~{S})-2-(hydroxymethyl)-6-[(1~{S},2~{R}...
+分子 #14: (4R,7R)-4-hydroxy-N,N,N-trimethyl-4,9-dioxo-7-[(undecanoyloxy)met...
+分子 #15: MANGANESE (II) ION
+分子 #16: (2E,6E,10E,14E,18E,22E,26E)-3,7,11,15,19,23,27,31-OCTAMETHYLDOTRI...
+分子 #17: 5-(dimethylsulfamoyl)-~{N}-(5-methyl-1,3-thiazol-2-yl)-2-pyrrolid...
+分子 #18: water
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 54.2 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.6 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.61 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 101699 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)