+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Catalytic module of yeast GID E3 ligase bound to multiphosphorylated Ubc8~ubiquitin | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | E3 ubiquitin ligase / E2 ubiquitin-conjugating enzyme / phosphorylation / GID / LIGASE | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報GID complex / mitochondrial outer membrane translocase complex assembly / Regulation of pyruvate metabolism / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / E2 ubiquitin-conjugating enzyme / ubiquitin conjugating enzyme activity / Antigen processing: Ubiquitination & Proteasome degradation / negative regulation of gluconeogenesis / Maturation of protein E / Maturation of protein E ...GID complex / mitochondrial outer membrane translocase complex assembly / Regulation of pyruvate metabolism / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / E2 ubiquitin-conjugating enzyme / ubiquitin conjugating enzyme activity / Antigen processing: Ubiquitination & Proteasome degradation / negative regulation of gluconeogenesis / Maturation of protein E / Maturation of protein E / ER Quality Control Compartment (ERQC) / Myoclonic epilepsy of Lafora / FLT3 signaling by CBL mutants / Prevention of phagosomal-lysosomal fusion / IRAK2 mediated activation of TAK1 complex / Alpha-protein kinase 1 signaling pathway / Glycogen synthesis / IRAK1 recruits IKK complex / IRAK1 recruits IKK complex upon TLR7/8 or 9 stimulation / Membrane binding and targetting of GAG proteins / Endosomal Sorting Complex Required For Transport (ESCRT) / Regulation of TBK1, IKKε (IKBKE)-mediated activation of IRF3, IRF7 / Negative regulation of FLT3 / PTK6 Regulates RTKs and Their Effectors AKT1 and DOK1 / Regulation of TBK1, IKKε-mediated activation of IRF3, IRF7 upon TLR3 ligation / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / Constitutive Signaling by NOTCH1 HD Domain Mutants / NOTCH2 Activation and Transmission of Signal to the Nucleus / TICAM1,TRAF6-dependent induction of TAK1 complex / TICAM1-dependent activation of IRF3/IRF7 / APC/C:Cdc20 mediated degradation of Cyclin B / Regulation of FZD by ubiquitination / Downregulation of ERBB4 signaling / p75NTR recruits signalling complexes / APC-Cdc20 mediated degradation of Nek2A / InlA-mediated entry of Listeria monocytogenes into host cells / TRAF6 mediated IRF7 activation in TLR7/8 or 9 signaling / TRAF6-mediated induction of TAK1 complex within TLR4 complex / Regulation of pyruvate metabolism / Regulation of innate immune responses to cytosolic DNA / NF-kB is activated and signals survival / Downregulation of ERBB2:ERBB3 signaling / Pexophagy / NRIF signals cell death from the nucleus / VLDLR internalisation and degradation / Regulation of PTEN localization / Activated NOTCH1 Transmits Signal to the Nucleus / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / Regulation of BACH1 activity / MAP3K8 (TPL2)-dependent MAPK1/3 activation / TICAM1, RIP1-mediated IKK complex recruitment / Translesion synthesis by REV1 / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / Translesion synthesis by POLK / InlB-mediated entry of Listeria monocytogenes into host cell / Downregulation of TGF-beta receptor signaling / Josephin domain DUBs / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / Regulation of activated PAK-2p34 by proteasome mediated degradation / Translesion synthesis by POLI / IKK complex recruitment mediated by RIP1 / Gap-filling DNA repair synthesis and ligation in GG-NER / PINK1-PRKN Mediated Mitophagy / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) / TNFR1-induced NF-kappa-B signaling pathway / Autodegradation of Cdh1 by Cdh1:APC/C / APC/C:Cdc20 mediated degradation of Securin / TCF dependent signaling in response to WNT / N-glycan trimming in the ER and Calnexin/Calreticulin cycle / Regulation of NF-kappa B signaling / Asymmetric localization of PCP proteins / Ubiquitin-dependent degradation of Cyclin D / SCF-beta-TrCP mediated degradation of Emi1 / NIK-->noncanonical NF-kB signaling / activated TAK1 mediates p38 MAPK activation / Negative regulators of DDX58/IFIH1 signaling / TNFR2 non-canonical NF-kB pathway / AUF1 (hnRNP D0) binds and destabilizes mRNA / Regulation of signaling by CBL / NOTCH3 Activation and Transmission of Signal to the Nucleus / Vpu mediated degradation of CD4 / Assembly of the pre-replicative complex / Ubiquitin-Mediated Degradation of Phosphorylated Cdc25A / Degradation of DVL / Deactivation of the beta-catenin transactivating complex / Negative regulation of FGFR3 signaling / Cdc20:Phospho-APC/C mediated degradation of Cyclin A / Dectin-1 mediated noncanonical NF-kB signaling / Fanconi Anemia Pathway / Peroxisomal protein import / Degradation of AXIN / Regulation of TNFR1 signaling / Negative regulation of FGFR2 signaling / Stabilization of p53 / Hh mutants are degraded by ERAD / Negative regulation of FGFR4 signaling / Downregulation of SMAD2/3:SMAD4 transcriptional activity / Activation of NF-kappaB in B cells / Negative regulation of FGFR1 signaling / EGFR downregulation 類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
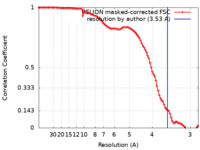
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.53 Å | ||||||||||||
 データ登録者 データ登録者 | Chrustowicz J / Sherpa D / Prabu RJ / Schulman BA | ||||||||||||
| 資金援助 |  ドイツ, European Union, 3件 ドイツ, European Union, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2024 ジャーナル: Mol Cell / 年: 2024タイトル: Multisite phosphorylation dictates selective E2-E3 pairing as revealed by Ubc8/UBE2H-GID/CTLH assemblies. 著者: Jakub Chrustowicz / Dawafuti Sherpa / Jerry Li / Christine R Langlois / Eleftheria C Papadopoulou / D Tung Vu / Laura A Hehl / Özge Karayel / Viola Beier / Susanne von Gronau / Judith ...著者: Jakub Chrustowicz / Dawafuti Sherpa / Jerry Li / Christine R Langlois / Eleftheria C Papadopoulou / D Tung Vu / Laura A Hehl / Özge Karayel / Viola Beier / Susanne von Gronau / Judith Müller / J Rajan Prabu / Matthias Mann / Gary Kleiger / Arno F Alpi / Brenda A Schulman /   要旨: Ubiquitylation is catalyzed by coordinated actions of E3 and E2 enzymes. Molecular principles governing many important E3-E2 partnerships remain unknown, including those for RING-family GID/CTLH E3 ...Ubiquitylation is catalyzed by coordinated actions of E3 and E2 enzymes. Molecular principles governing many important E3-E2 partnerships remain unknown, including those for RING-family GID/CTLH E3 ubiquitin ligases and their dedicated E2, Ubc8/UBE2H (yeast/human nomenclature). GID/CTLH-Ubc8/UBE2H-mediated ubiquitylation regulates biological processes ranging from yeast metabolic signaling to human development. Here, cryoelectron microscopy (cryo-EM), biochemistry, and cell biology reveal this exquisitely specific E3-E2 pairing through an unconventional catalytic assembly and auxiliary interactions 70-100 Å away, mediated by E2 multisite phosphorylation. Rather than dynamic polyelectrostatic interactions reported for other ubiquitylation complexes, multiple Ubc8/UBE2H phosphorylation sites within acidic CK2-targeted sequences specifically anchor the E2 C termini to E3 basic patches. Positions of phospho-dependent interactions relative to the catalytic domains correlate across evolution. Overall, our data show that phosphorylation-dependent multivalency establishes a specific E3-E2 partnership, is antagonistic with dephosphorylation, rigidifies the catalytic centers within a flexing GID E3-substrate assembly, and facilitates substrate collision with ubiquitylation active sites. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_17764.map.gz emd_17764.map.gz | 5.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-17764-v30.xml emd-17764-v30.xml emd-17764.xml emd-17764.xml | 23.4 KB 23.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_17764_fsc.xml emd_17764_fsc.xml | 9.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_17764.png emd_17764.png | 108 KB | ||
| マスクデータ |  emd_17764_msk_1.map emd_17764_msk_1.map | 76.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-17764.cif.gz emd-17764.cif.gz | 6.9 KB | ||
| その他 |  emd_17764_additional_1.map.gz emd_17764_additional_1.map.gz emd_17764_half_map_1.map.gz emd_17764_half_map_1.map.gz emd_17764_half_map_2.map.gz emd_17764_half_map_2.map.gz | 66.8 MB 60 MB 60 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-17764 http://ftp.pdbj.org/pub/emdb/structures/EMD-17764 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17764 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-17764 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8pmqMC  8pjnC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_17764.map.gz / 形式: CCP4 / 大きさ: 76.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_17764.map.gz / 形式: CCP4 / 大きさ: 76.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.427 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_17764_msk_1.map emd_17764_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Map post-processed with DeepEMhancer
| ファイル | emd_17764_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map post-processed with DeepEMhancer | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_17764_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_17764_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of yeast Chelator-GIDSR4 E3 ligase, tetrameric Fbp1 subst...
| 全体 | 名称: Complex of yeast Chelator-GIDSR4 E3 ligase, tetrameric Fbp1 substrate and multiphosphorylated Ubc8~ubiquitin |
|---|---|
| 要素 |
|
-超分子 #1: Complex of yeast Chelator-GIDSR4 E3 ligase, tetrameric Fbp1 subst...
| 超分子 | 名称: Complex of yeast Chelator-GIDSR4 E3 ligase, tetrameric Fbp1 substrate and multiphosphorylated Ubc8~ubiquitin タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 詳細: Map obtained by focus refinement over the catalytic module (Gid2, Gid9) and Ubc8~ubiquitin |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 1.7 MDa |
-分子 #1: E3 ubiquitin-protein ligase RMD5
| 分子 | 名称: E3 ubiquitin-protein ligase RMD5 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: RING-type E3 ubiquitin transferase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 49.244594 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MSELLDSFET EFAKFYTDSN LEETNLQKCL DHTHEFKSQL KKLKAHLNKH IQESKPEVYN KLSDKEKQKF KRKRELIIEK LSKSQRQWD HSVKKQIKYV SQQSNRFNKS TLNKLKEFDI DSVYVNKLPK ETMENVNEAI GYHILRYSID NMPLGNKNEA F QYLKDVYG ...文字列: MSELLDSFET EFAKFYTDSN LEETNLQKCL DHTHEFKSQL KKLKAHLNKH IQESKPEVYN KLSDKEKQKF KRKRELIIEK LSKSQRQWD HSVKKQIKYV SQQSNRFNKS TLNKLKEFDI DSVYVNKLPK ETMENVNEAI GYHILRYSID NMPLGNKNEA F QYLKDVYG ITNKESTEFI EMGQIVHDLK KGDTESCLKW CSNEMESLSS NHTALSSLKF DLYTLSAMQI VKHGNPVELY YQ ITQNAPL DCFRHREKEL MQNVVPLLTK SLIGQPIEDI DSKVNKELKE CTSLFIKEYC AAKHIFFDSP LFLIVLSGLI SFQ FFIKYK TIRELAHVDW TTKDELPFDV KLPDFLTHFH PIFICPVLKE ETTTENPPYS LACHHIISKK ALDRLSKNGT ITFK CPYCP VNTSMSSTKK VRFVML UniProtKB: E3 ubiquitin-protein ligase RMD5 |
-分子 #2: Protein FYV10
| 分子 | 名称: Protein FYV10 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO / EC番号: RING-type E3 ubiquitin transferase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 59.975102 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MAEKSIFNEP DVDFHLKLNQ QLFHIPYELL SKRIKHTQAV INKETKSLHE HTAALNQIFE HNDVEHDELA LAKITEMIRK VDHIERFLN TQIKSYCQIL NRIKKRLEFF HELKDIKSQN SGTSHNGNNE GTRTKLIQWY QSYTNILIGD YLTRNNPIKY N SETKDHWN ...文字列: MAEKSIFNEP DVDFHLKLNQ QLFHIPYELL SKRIKHTQAV INKETKSLHE HTAALNQIFE HNDVEHDELA LAKITEMIRK VDHIERFLN TQIKSYCQIL NRIKKRLEFF HELKDIKSQN SGTSHNGNNE GTRTKLIQWY QSYTNILIGD YLTRNNPIKY N SETKDHWN SGVVFLKQSQ LDDLIDYDVL LEANRISTSL LHERNLLPLI SWINENKKTL TKKSSILEFQ ARLQEYIELL KV DNYTDAI VCFQRFLLPF VKSNFTDLKL ASGLLIFIKY CNDQKPTSST SSGFDTEEIK SQSLPMKKDR IFQHFFHKSL PRI TSKPAV NTTDYDKSSL INLQSGDFER YLNLLDDQRW SVLNDLFLSD FYSMYGISQN DPLLIYLSLG ISSLKTRDCL HPSD DENGN QETETATTAE KEVEDLQLFT LHSLKRKNCP VCSETFKPIT QALPFAHHIQ SQLFENPILL PNGNVYDSKK LKKLA KTLK KQNLISLNPG QIMDPVDMKI FCESDSIKMY PT UniProtKB: GID complex subunit 9 |
-分子 #3: Ubiquitin-conjugating enzyme E2-24 kDa
| 分子 | 名称: Ubiquitin-conjugating enzyme E2-24 kDa / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO / EC番号: E2 ubiquitin-conjugating enzyme |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 24.920771 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MSSSKRRIET DVMKLLMSDH QVDLINDSMQ EFHVKFLGPK DTPYENGVWR LHVELPDNYP YKSPSIGFVN KIFHPNIDIA SGSIKLDVI NSTWSPLYDL INIVEWMIPG LLKEPNGSDP LNNEAATLQL RDKKLYEEKI KEYIDKYATK EKYQQMFGGD N DSDDSDSG ...文字列: MSSSKRRIET DVMKLLMSDH QVDLINDSMQ EFHVKFLGPK DTPYENGVWR LHVELPDNYP YKSPSIGFVN KIFHPNIDIA SGSIKLDVI NSTWSPLYDL INIVEWMIPG LLKEPNGSDP LNNEAATLQL RDKKLYEEKI KEYIDKYATK EKYQQMFGGD N DSDDSDSG GDLQEEDSDS DEDMDGTGVS SGDDSVDEL(SEP) EDL(SEP)DIDV(SEP)D DDDYDEVANQ UniProtKB: Ubiquitin-conjugating enzyme E2-24 kDa |
-分子 #4: Ubiquitin
| 分子 | 名称: Ubiquitin / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 8.576831 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MQIFVKTLTG KTITLEVEPS DTIENVKAKI QDKEGIPPDQ QRLIFAGKQL EDGRTLSDYN IQKESTLHLV LRLRGG UniProtKB: Polyubiquitin-C |
-分子 #5: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 5 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 69.24 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー

































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)