+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
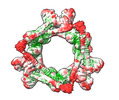
| タイトル | HSF2BP-BRCA2 ring-shaped complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Meiosis / Cancer Antigen / DNA repair / Fertility / Armadillo domain / Intrinsically Disordered Protein / RECOMBINATION | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
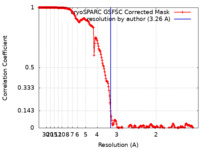
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.26 Å | |||||||||
 データ登録者 データ登録者 | Zinn-Justin S / Ghouil R / Miron S / Legrand P / Ouldali M / Winter JM / Ropars V / Arteni AA | |||||||||
| 資金援助 | European Union,  フランス, 2件 フランス, 2件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2023 ジャーナル: Sci Adv / 年: 2023タイトル: BRCA2-HSF2BP oligomeric ring disassembly by BRME1 promotes homologous recombination. 著者: Rania Ghouil / Simona Miron / Koichi Sato / Dejan Ristic / Sari E van Rossum-Fikkert / Pierre Legrand / Malika Ouldali / Jean-Marie Winter / Virginie Ropars / Gabriel David / Ana-Andreea ...著者: Rania Ghouil / Simona Miron / Koichi Sato / Dejan Ristic / Sari E van Rossum-Fikkert / Pierre Legrand / Malika Ouldali / Jean-Marie Winter / Virginie Ropars / Gabriel David / Ana-Andreea Arteni / Claire Wyman / Puck Knipscheer / Roland Kanaar / Alex N Zelensky / Sophie Zinn-Justin /   要旨: In meiotic homologous recombination (HR), BRCA2 facilitates loading of the recombinases RAD51 and DMC1 at the sites of double-strand breaks (DSBs). The HSF2BP-BRME1 complex interacts with BRCA2. Its ...In meiotic homologous recombination (HR), BRCA2 facilitates loading of the recombinases RAD51 and DMC1 at the sites of double-strand breaks (DSBs). The HSF2BP-BRME1 complex interacts with BRCA2. Its absence causes a severe reduction in recombinase loading at meiotic DSB. We previously showed that, in somatic cancer cells ectopically producing HSF2BP, DNA damage can trigger HSF2BP-dependent degradation of BRCA2, which prevents HR. Here, we report that, upon binding to BRCA2, HSF2BP forms octameric rings that are able to interlock into a large ring-shaped 24-mer. Addition of BRME1 leads to dissociation of both of these ring structures and cancels the disruptive effect of HSF2BP on cancer cell resistance to DNA damage. It also prevents BRCA2 degradation during interstrand DNA crosslink repair in egg extracts. We propose that, during meiosis, the control of HSF2BPBRCA2 oligomerization by BRME1 ensures timely assembly of the ring complex that concentrates BRCA2 and controls its turnover, thus promoting HR. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16432.map.gz emd_16432.map.gz | 404.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16432-v30.xml emd-16432-v30.xml emd-16432.xml emd-16432.xml | 18.5 KB 18.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16432_fsc.xml emd_16432_fsc.xml | 19.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16432.png emd_16432.png | 121.7 KB | ||
| Filedesc metadata |  emd-16432.cif.gz emd-16432.cif.gz | 5.7 KB | ||
| その他 |  emd_16432_half_map_1.map.gz emd_16432_half_map_1.map.gz emd_16432_half_map_2.map.gz emd_16432_half_map_2.map.gz | 763.6 MB 763.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16432 http://ftp.pdbj.org/pub/emdb/structures/EMD-16432 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16432 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16432 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16432_validation.pdf.gz emd_16432_validation.pdf.gz | 917.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16432_full_validation.pdf.gz emd_16432_full_validation.pdf.gz | 917.5 KB | 表示 | |
| XML形式データ |  emd_16432_validation.xml.gz emd_16432_validation.xml.gz | 29.6 KB | 表示 | |
| CIF形式データ |  emd_16432_validation.cif.gz emd_16432_validation.cif.gz | 39 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16432 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16432 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16432 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16432 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16432.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16432.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.73 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_16432_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
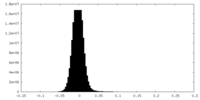
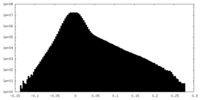
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_16432_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
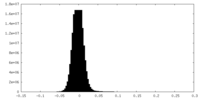
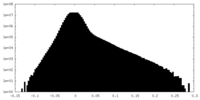
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex between HSF2BP and the BRCA2 fragment N2291-Q2342
| 全体 | 名称: Complex between HSF2BP and the BRCA2 fragment N2291-Q2342 |
|---|---|
| 要素 |
|
-超分子 #1: Complex between HSF2BP and the BRCA2 fragment N2291-Q2342
| 超分子 | 名称: Complex between HSF2BP and the BRCA2 fragment N2291-Q2342 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: The complex contains 24 HSF2BP molecules and 12 BRCA2 peptides |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 900 kDa/nm |
-分子 #1: HSF2BP
| 分子 | 名称: HSF2BP / タイプ: protein_or_peptide / ID: 1 / 詳細: Full-length human HSF2BP / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGEAGAAEEA CRHMGTKEEF VKVRKKDLER LTTEVMQIRD FLPRILNGEV LESFQKLKIV EKNLERKEQ ELEQLKMDCE HFKARLETVQ ADNIREKKEK LALRQQLNEA KQQLLQQAEY C TEMGAAAC TLLWGVSSSE EVVKAILGGD KALKFFSITG QTMESFVKSL ...文字列: MGEAGAAEEA CRHMGTKEEF VKVRKKDLER LTTEVMQIRD FLPRILNGEV LESFQKLKIV EKNLERKEQ ELEQLKMDCE HFKARLETVQ ADNIREKKEK LALRQQLNEA KQQLLQQAEY C TEMGAAAC TLLWGVSSSE EVVKAILGGD KALKFFSITG QTMESFVKSL DGDVQELDSD ES QFVFALA GIVTNVAAIA CGREFLVNSS RVLLDTILQL LGDLKPGQCT KLKVLMLMSL YNV SINLKG LKYISESPGF IPLLWWLLSD PDAEVCLHVL RLVQSVVLEP EVFSKSASEF RSSL PLQRI LAMSKSRNPR LQTAAQELLE DLRTLEHNV |
-分子 #2: BRCA2
| 分子 | 名称: BRCA2 / タイプ: protein_or_peptide / ID: 2 詳細: BRCA2 from N2291 to Q2342 with a C-terminal TEV site (was produced fused to GB1-6His) 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: NEFDRIIENQ EKSLKASKST PDGTIKDRRL FMHHVSLEPI TTVPFRTTKE RQENLYFQ |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: GOLD / メッシュ: 300 | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV | ||||||||||||
| 詳細 | Obtained after gel filtration on the complex |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: TFS Selectris X / エネルギーフィルター - スリット幅: 10 eV |
| 撮影 | フィルム・検出器のモデル: TFS FALCON 4i (4k x 4k) 実像数: 9531 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.4 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)