+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of Ku heterodimer bound to DNA, PAXX and XLF | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | NHEJ / Ku70 / Ku80 / DNA damage / DNA BINDING PROTEIN / XLF | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of ligase activity / DNA ligase IV complex / Ku70:Ku80 complex / negative regulation of t-circle formation / DNA end binding / small-subunit processome assembly / positive regulation of lymphocyte differentiation / DNA-dependent protein kinase complex / DNA-dependent protein kinase-DNA ligase 4 complex / immunoglobulin V(D)J recombination ...positive regulation of ligase activity / DNA ligase IV complex / Ku70:Ku80 complex / negative regulation of t-circle formation / DNA end binding / small-subunit processome assembly / positive regulation of lymphocyte differentiation / DNA-dependent protein kinase complex / DNA-dependent protein kinase-DNA ligase 4 complex / immunoglobulin V(D)J recombination / nonhomologous end joining complex / regulation of smooth muscle cell proliferation / cellular response to X-ray / nuclear telomere cap complex / double-strand break repair via classical nonhomologous end joining / Cytosolic sensors of pathogen-associated DNA / IRF3-mediated induction of type I IFN / positive regulation of neurogenesis / regulation of telomere maintenance / recombinational repair / U3 snoRNA binding / protein localization to chromosome, telomeric region / response to ionizing radiation / cellular hyperosmotic salinity response / 2-LTR circle formation / telomeric DNA binding / hematopoietic stem cell proliferation / positive regulation of protein kinase activity / site of DNA damage / 付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ / T cell differentiation / 5'-deoxyribose-5-phosphate lyase activity / hematopoietic stem cell differentiation / ATP-dependent activity, acting on DNA / telomere maintenance via telomerase / DNA polymerase binding / neurogenesis / telomere maintenance / activation of innate immune response / DNA helicase activity / cyclin binding / cellular response to leukemia inhibitory factor / central nervous system development / B cell differentiation / small-subunit processome / Nonhomologous End-Joining (NHEJ) / enzyme activator activity / cellular response to gamma radiation / protein-DNA complex / double-strand break repair via nonhomologous end joining / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / fibrillar center / double-strand break repair / site of double-strand break / double-stranded DNA binding / scaffold protein binding / secretory granule lumen / DNA recombination / molecular adaptor activity / transcription regulator complex / ficolin-1-rich granule lumen / damaged DNA binding / chromosome, telomeric region / transcription cis-regulatory region binding / ribonucleoprotein complex / innate immune response / negative regulation of DNA-templated transcription / DNA damage response / ubiquitin protein ligase binding / Neutrophil degranulation / positive regulation of DNA-templated transcription / protein-containing complex binding / nucleolus / protein homodimerization activity / positive regulation of transcription by RNA polymerase II / protein-containing complex / ATP hydrolysis activity / DNA binding / RNA binding / extracellular region / nucleoplasm / ATP binding / identical protein binding / nucleus / membrane / plasma membrane / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.68 Å | |||||||||
 データ登録者 データ登録者 | Hardwick SW / Kefala-Stavridi A / Chirgadze DY / Blundell TL / Chaplin AK | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2023 ジャーナル: Sci Adv / 年: 2023タイトル: PAXX binding to the NHEJ machinery explains functional redundancy with XLF. 著者: Murielle Seif-El-Dahan / Antonia Kefala-Stavridi / Philippe Frit / Steven W Hardwick / Dima Y Chirgadze / Taiana Maia De Oliviera / Jessica Andreani / Sébastien Britton / Nadia Barboule / ...著者: Murielle Seif-El-Dahan / Antonia Kefala-Stavridi / Philippe Frit / Steven W Hardwick / Dima Y Chirgadze / Taiana Maia De Oliviera / Jessica Andreani / Sébastien Britton / Nadia Barboule / Madeleine Bossaert / Arun Prasad Pandurangan / Katheryn Meek / Tom L Blundell / Virginie Ropars / Patrick Calsou / Jean-Baptiste Charbonnier / Amanda K Chaplin /    要旨: Nonhomologous end joining is a critical mechanism that repairs DNA double-strand breaks in human cells. In this work, we address the structural and functional role of the accessory protein PAXX ...Nonhomologous end joining is a critical mechanism that repairs DNA double-strand breaks in human cells. In this work, we address the structural and functional role of the accessory protein PAXX [paralog of x-ray repair cross-complementing protein 4 (XRCC4) and XRCC4-like factor (XLF)] in this mechanism. Here, we report high-resolution cryo-electron microscopy (cryo-EM) and x-ray crystallography structures of the PAXX C-terminal Ku-binding motif bound to Ku70/80 and cryo-EM structures of PAXX bound to two alternate DNA-dependent protein kinase (DNA-PK) end-bridging dimers, mediated by either Ku80 or XLF. We identify residues critical for the Ku70/PAXX interaction in vitro and in cells. We demonstrate that PAXX and XLF can bind simultaneously to the Ku heterodimer and act as structural bridges in alternate forms of DNA-PK dimers. Last, we show that engagement of both proteins provides a complementary advantage for DNA end synapsis and end joining in cells. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15022.map.gz emd_15022.map.gz | 226.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15022-v30.xml emd-15022-v30.xml emd-15022.xml emd-15022.xml | 22.5 KB 22.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15022_fsc.xml emd_15022_fsc.xml | 13.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15022.png emd_15022.png | 60.1 KB | ||
| Filedesc metadata |  emd-15022.cif.gz emd-15022.cif.gz | 7.4 KB | ||
| その他 |  emd_15022_half_map_1.map.gz emd_15022_half_map_1.map.gz emd_15022_half_map_2.map.gz emd_15022_half_map_2.map.gz | 226.5 MB 226.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15022 http://ftp.pdbj.org/pub/emdb/structures/EMD-15022 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15022 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15022 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15022_validation.pdf.gz emd_15022_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15022_full_validation.pdf.gz emd_15022_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_15022_validation.xml.gz emd_15022_validation.xml.gz | 21 KB | 表示 | |
| CIF形式データ |  emd_15022_validation.cif.gz emd_15022_validation.cif.gz | 26.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15022 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15022 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15022 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15022 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15022.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15022.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.65 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_15022_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
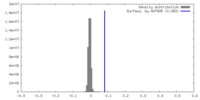
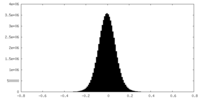
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_15022_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
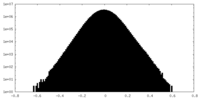
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ku70/80 hetero dimer bound to DNA, PAXX and XLF
| 全体 | 名称: Ku70/80 hetero dimer bound to DNA, PAXX and XLF |
|---|---|
| 要素 |
|
-超分子 #1: Ku70/80 hetero dimer bound to DNA, PAXX and XLF
| 超分子 | 名称: Ku70/80 hetero dimer bound to DNA, PAXX and XLF / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4, #6 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 160 KDa |
-分子 #1: X-ray repair cross-complementing protein 6
| 分子 | 名称: X-ray repair cross-complementing protein 6 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 69.945039 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSGWESYYKT EGDEEAEEEQ EENLEASGDY KYSGRDSLIF LVDASKAMFE SQSEDELTPF DMSIQCIQSV YISKIISSDR DLLAVVFYG TEKDKNSVNF KNIYVLQELD NPGAKRILEL DQFKGQQGQK RFQDMMGHGS DYSLSEVLWV CANLFSDVQF K MSHKRIML ...文字列: MSGWESYYKT EGDEEAEEEQ EENLEASGDY KYSGRDSLIF LVDASKAMFE SQSEDELTPF DMSIQCIQSV YISKIISSDR DLLAVVFYG TEKDKNSVNF KNIYVLQELD NPGAKRILEL DQFKGQQGQK RFQDMMGHGS DYSLSEVLWV CANLFSDVQF K MSHKRIML FTNEDNPHGN DSAKASRART KAGDLRDTGI FLDLMHLKKP GGFDISLFYR DIISIAEDED LRVHFEESSK LE DLLRKVR AKETRKRALS RLKLKLNKDI VISVGIYNLV QKALKPPPIK LYRETNEPVK TKTRTFNTST GGLLLPSDTK RSQ IYGSRQ IILEKEETEE LKRFDDPGLM LMGFKPLVLL KKHHYLRPSL FVYPEESLVI GSSTLFSALL IKCLEKEVAA LCRY TPRRN IPPYFVALVP QEEELDDQKI QVTPPGFQLV FLPFADDKRK MPFTEKIMAT PEQVGKMKAI VEKLRFTYRS DSFEN PVLQ QHFRNLEALA LDLMEPEQAV DLTLPKVEAM NKRLGSLVDE FKELVYPPDY NPEGKVTKRK HDNEGSGSKR PKVEYS EEE LKTHISKGTL GKFTVPMLKE ACRAYGLKSG LKKQELLEAL TKHFQD UniProtKB: X-ray repair cross-complementing protein 6 |
-分子 #2: X-ray repair cross-complementing protein 5
| 分子 | 名称: X-ray repair cross-complementing protein 5 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 82.812438 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MVRSGNKAAV VLCMDVGFTM SNSIPGIESP FEQAKKVITM FVQRQVFAEN KDEIALVLFG TDGTDNPLSG GDQYQNITVH RHLMLPDFD LLEDIESKIQ PGSQQADFLD ALIVSMDVIQ HETIGKKFEK RHIEIFTDLS SRFSKSQLDI IIHSLKKCDI S LQFFLPFS ...文字列: MVRSGNKAAV VLCMDVGFTM SNSIPGIESP FEQAKKVITM FVQRQVFAEN KDEIALVLFG TDGTDNPLSG GDQYQNITVH RHLMLPDFD LLEDIESKIQ PGSQQADFLD ALIVSMDVIQ HETIGKKFEK RHIEIFTDLS SRFSKSQLDI IIHSLKKCDI S LQFFLPFS LGKEDGSGDR GDGPFRLGGH GPSFPLKGIT EQQKEGLEIV KMVMISLEGE DGLDEIYSFS ESLRKLCVFK KI ERHSIHW PCRLTIGSNL SIRIAAYKSI LQERVKKTWT VVDAKTLKKE DIQKETVYCL NDDDETEVLK EDIIQGFRYG SDI VPFSKV DEEQMKYKSE GKCFSVLGFC KSSQVQRRFF MGNQVLKVFA ARDDEAAAVA LSSLIHALDD LDMVAIVRYA YDKR ANPQV GVAFPHIKHN YECLVYVQLP FMEDLRQYMF SSLKNSKKYA PTEAQLNAVD ALIDSMSLAK KDEKTDTLED LFPTT KIPN PRFQRLFQCL LHRALHPREP LPPIQQHIWN MLNPPAEVTT KSQIPLSKIK TLFPLIEAKK KDQVTAQEIF QDNHED GPT AKKLKTEQGG AHFSVSSLAE GSVTSVGSVN PAENFRVLVK QKKASFEEAS NQLINHIEQF LDTNETPYFM KSIDCIR AF REEAIKFSEE QRFNNFLKAL QEKVEIKQLN HFWEIVVQDG ITLITKEEAS GSSVTAEEAK KFLAPKDKPS GDTAAVFE E GGDVDDLLDM I UniProtKB: X-ray repair cross-complementing protein 5 |
-分子 #3: Protein PAXX
| 分子 | 名称: Protein PAXX / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 21.663498 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDPLSPPLCT LPPGPEPPRF VCYCEGEESG EGDRGGFNLY VTDAAELWST CFTPDSLAAL KARFGLSAAE DITPRFRAAC EQQAVALTL QEDRASLTLS GGPSALAFDL SKVPGPEAAP RLRALTLGLA KRVWSLERRL AAAEETAVSP RKSPRPAGPQ L FLPDPDPQ ...文字列: MDPLSPPLCT LPPGPEPPRF VCYCEGEESG EGDRGGFNLY VTDAAELWST CFTPDSLAAL KARFGLSAAE DITPRFRAAC EQQAVALTL QEDRASLTLS GGPSALAFDL SKVPGPEAAP RLRALTLGLA KRVWSLERRL AAAEETAVSP RKSPRPAGPQ L FLPDPDPQ RGGPGPGVRR RCPGESLINP GFKSKKPAGG VDFDET UniProtKB: Protein PAXX |
-分子 #4: Non-homologous end-joining factor 1
| 分子 | 名称: Non-homologous end-joining factor 1 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 33.372234 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MEELEQGLLM QPWAWLQLAE NSLLAKVFIT KQGYALLVSD LQQVWHEQVD TSVVSQRAKE LNKRLTAPPA AFLCHLDNLL RPLLKDAAH PSEATFSCDC VADALILRVR SELSGLPFYW NFHCMLASPS LVSQHLIRPL MGMSLALQCQ VRELATLLHM K DLEIQDYQ ...文字列: MEELEQGLLM QPWAWLQLAE NSLLAKVFIT KQGYALLVSD LQQVWHEQVD TSVVSQRAKE LNKRLTAPPA AFLCHLDNLL RPLLKDAAH PSEATFSCDC VADALILRVR SELSGLPFYW NFHCMLASPS LVSQHLIRPL MGMSLALQCQ VRELATLLHM K DLEIQDYQ ESGATLIRDR LKTEPFEENS FLEQFMIEKL PEACSIGDGK PFVMNLQDLY MAVTTQEVQV GQKHQGAGDP HT SNSASLQ GIDSQCVNQP EQLVSSAPTL SAPEKESTGT SGPLQRPQLS KVKRKKPRGL FS UniProtKB: Non-homologous end-joining factor 1 |
-分子 #5: DNA
| 分子 | 名称: DNA / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 4.503948 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DC)(DC)(DT)(DC)(DT)(DA)(DG) (DA)(DT)(DA)(DT)(DC) |
-分子 #6: DNA
| 分子 | 名称: DNA / タイプ: dna / ID: 6 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 4.673059 KDa |
| 配列 | 文字列: (DG)(DA)(DT)(DA)(DT)(DC)(DT)(DA)(DG)(DA) (DG)(DG)(DG)(DA)(DT) |
-分子 #7: PHOSPHATE ION
| 分子 | 名称: PHOSPHATE ION / タイプ: ligand / ID: 7 / コピー数: 1 / 式: PO4 |
|---|---|
| 分子量 | 理論値: 94.971 Da |
| Chemical component information |  ChemComp-PO4: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 13024 / 平均露光時間: 1.37 sec. / 平均電子線量: 52.1 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






















 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)