+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Mot1:TBP - product state | |||||||||
 マップデータ マップデータ | main map | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Chaetomium thermophilum (菌類) Chaetomium thermophilum (菌類) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.5 Å | |||||||||
 データ登録者 データ登録者 | Woike S / Eustermann S / Jung J / Wenzl SJ / Hagemann G / Bartho JD / Lammens K / Butryn A / Herzog F / Hopfner K-P | |||||||||
| 資金援助 |  ドイツ, European Union, 2件 ドイツ, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Structural basis for TBP displacement from TATA box DNA by the Swi2/Snf2 ATPase Mot1. 著者: Stephan Woike / Sebastian Eustermann / James Jung / Simon Josef Wenzl / Götz Hagemann / Joseph Bartho / Katja Lammens / Agata Butryn / Franz Herzog / Karl-Peter Hopfner /     要旨: The Swi2/Snf2 family transcription regulator Modifier of Transcription 1 (Mot1) uses adenosine triphosphate (ATP) to dissociate and reallocate the TATA box-binding protein (TBP) from and between ...The Swi2/Snf2 family transcription regulator Modifier of Transcription 1 (Mot1) uses adenosine triphosphate (ATP) to dissociate and reallocate the TATA box-binding protein (TBP) from and between promoters. To reveal how Mot1 removes TBP from TATA box DNA, we determined cryogenic electron microscopy structures that capture different states of the remodeling reaction. The resulting molecular video reveals how Mot1 dissociates TBP in a process that, intriguingly, does not require DNA groove tracking. Instead, the motor grips DNA in the presence of ATP and swings back after ATP hydrolysis, moving TBP to a thermodynamically less stable position on DNA. Dislodged TBP is trapped by a chaperone element that blocks TBP's DNA binding site. Our results show how Swi2/Snf2 proteins can remodel protein-DNA complexes through DNA bending without processive DNA tracking and reveal mechanistic similarities to RNA gripping DEAD box helicases and RIG-I-like immune sensors. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14554.map.gz emd_14554.map.gz | 79 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14554-v30.xml emd-14554-v30.xml emd-14554.xml emd-14554.xml | 18.3 KB 18.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14554_fsc.xml emd_14554_fsc.xml | 10.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14554.png emd_14554.png | 47.3 KB | ||
| マスクデータ |  emd_14554_msk_1.map emd_14554_msk_1.map | 83.7 MB |  マスクマップ マスクマップ | |
| その他 |  emd_14554_half_map_1.map.gz emd_14554_half_map_1.map.gz emd_14554_half_map_2.map.gz emd_14554_half_map_2.map.gz | 77.7 MB 77.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14554 http://ftp.pdbj.org/pub/emdb/structures/EMD-14554 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14554 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14554 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14554_validation.pdf.gz emd_14554_validation.pdf.gz | 795.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14554_full_validation.pdf.gz emd_14554_full_validation.pdf.gz | 795.3 KB | 表示 | |
| XML形式データ |  emd_14554_validation.xml.gz emd_14554_validation.xml.gz | 17.6 KB | 表示 | |
| CIF形式データ |  emd_14554_validation.cif.gz emd_14554_validation.cif.gz | 22.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14554 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14554 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14554 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14554 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14554.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14554.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | main map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.059 Å | ||||||||||||||||||||||||||||||||||||
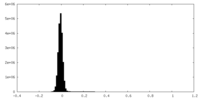
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_14554_msk_1.map emd_14554_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
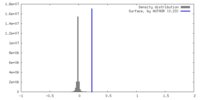
| 密度ヒストグラム |
-ハーフマップ: half map A
| ファイル | emd_14554_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
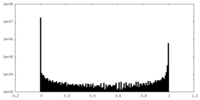
| 密度ヒストグラム |
-ハーフマップ: half map B
| ファイル | emd_14554_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
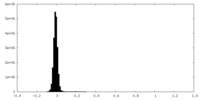
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Mot1:TBP complex after DNA release
| 全体 | 名称: Mot1:TBP complex after DNA release |
|---|---|
| 要素 |
|
-超分子 #1: Mot1:TBP complex after DNA release
| 超分子 | 名称: Mot1:TBP complex after DNA release / タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Chaetomium thermophilum (菌類) Chaetomium thermophilum (菌類) |
-分子 #1: Mot1:TBP complex
| 分子 | 名称: Mot1:TBP complex / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Chaetomium thermophilum (菌類) Chaetomium thermophilum (菌類) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MATRLDRLVT ILETGSTRLI RDTAVNQLAD WQKQHPEELF NLLSRVVPYL RHKDWETRTT AAKAIGKIIE NAPLYDPNAG QDEAAPEPTN GSFEVKKEEE KDVLEQDNFF RLESLDVATI VKYGRPLLRG GPVDYNLAAL DPQKRLAHLK KTLNGRLGLL GRVFEDEEMP ...文字列: MATRLDRLVT ILETGSTRLI RDTAVNQLAD WQKQHPEELF NLLSRVVPYL RHKDWETRTT AAKAIGKIIE NAPLYDPNAG QDEAAPEPTN GSFEVKKEEE KDVLEQDNFF RLESLDVATI VKYGRPLLRG GPVDYNLAAL DPQKRLAHLK KTLNGRLGLL GRVFEDEEMP VEQIASPITP NDAAGANGVG RQDGASNDNQ SQAIDESKMS ARQLNVLKRK RKREAQKAAQ GKSGFGDLSL RRSTTAGSDA FGEDTPMPDA DSKKNKLAEY FSLDRPENTE EDTKIVSEFK GPVLPIKSEI EADDSLEGAE WPFERLCEFL KVDLFDPQWE TRHGAAMGLR EVIRVHGAGA GRRRGKTRKE NNDLNRQWLD DLAYRLLCVL MLDKFTDYSS DTSVAPIRET VGQTLGAVLR HISVESVHAI YRLLYCMVTQ EDLPSEQNMW AVCHGGMVGL RYVVAVRKDL LLQDGDMIDG VVRCVMQGLG DIDDDVRSVS AATLIPMAKE FVMMRRSALD SLINIVWESL SNLGDDLSAS TGKIMDLLAT LCSFPEVLEA MKVSASQDEE RSFTLLVPRL YPFLRHTITS VRLAVLKALM TFANLGGETS QGWLNGRILR LIFQNIIVER DQDTLNMSLE LWTTLVRRLA ARDPAILADE FEAHAEPMMQ LALHPIGVPR HPIPMNPALF QKPSGGTYSL PGASQTNSRR SSPPEGERAT KRRRKSTKAE DVAPSTHTHD VDGHMIQGEV DLVGVDVLIR SRISAAKAMG LIMSFIPTPR LASYDTAVLQ ALSSPYASTQ LAAAMVIDEY AKNCSTPEVA SRFIEPLQKI IDLERPSHYR DLVTYVQRVR SASQQLINLF RDHGKVSQGK LPTLAVVVQG EPEAGPGAFS IANAEKVVNE DFERLKRLMA PGQRLIALPQ LNEAREQTVE VIEEAKAAKE ARDARIKAAA ACALVAMKVL PKKPSPLIKA IMDSIKTEEN QELQSRSAAT IARLVQLFTE SGRRGPAEKV VANLVKFSCV EVAETPEFPI HAHKTNVILS MQKEEDRVDH PDAVKYAREA KAARITRRGA KEALEILSKN FGAELLERVP TLRTFMEEPL VRAFSGDLPP EARDPENAFG QEIVDAMSVI RTMTPTLHPA LHPFVMQQVP LVIKALRSDL SVFRYMAAKC MATICSVITV DGMTALVEKV LPSINNPLDL SFRQGAIEVI YHLIAVMGDA ILPYVIFLIV PVLGRMSDSD NQIRLIATTS FATLVKLVPL EAGIPDPPGL SEELLKGRDR ERTFIAQLLD PKKIEPFKIP VAIKAELRSY QQEGVNWLAF LNKYHLHGIL CDDMGLGKTL QTICIVASDH HQRAEEFART GAPEVRKLPS LIICPPTLSG HWQQEIKTYA PFLTVTAYVG SPAERRAMKD SLDKTDIVIT SYDVCRNDID VIEKYNWNYC VLDEGHLIKN PKAKITLAVK RLTSNHRLIL TGTPIQNNVL ELWSLFDFLM PGFLGAEKVF LDRFAKPIAN SRYSKASSKE QEAGALAIEA LHKQVLPFLL RRLKEEVLND LPPKILQNYY CDLSDLQRKL FEDFTKREGK KITETAGRDD KEAKQHIFQA LQYMRKLCNS PALVMKPGHK AYEDTQKYLA KHGTTLEDPI HAPKLGALRD LLVDCGIGVE GQESSDPLYT PIKPHRALIF CQMKEMLDMV QNTVLKQMLP SVSYLRLDGS VEANKRQDIV NKFNSDPSYD VLLLTTSVGG LGLNLTGADT VIFVEHDWNP QKDLQAMDRA HRIGQKKVVN VYRIITRGTL EEKILSLQRF KIDVASTVVN QQNAGLATMD TDQILDLFNL GESGPSLITD NKESIEGREE DMVDIETGDV RRPGKKAAWL EGLGELWDNA QYEESFDLDG FLKTMQAAAW SHPQFEK MG SSHHHHHHSS GENLYFQGHM EAIQTHPANA AQAKAFTAPG SLSFPGGASE IANSTAPT N GASNGGQQQG VQATSGAGVT PATPAATPGA GPAGPSGITP TLQNIVATVN LDCRLDLKT IALHARNAEY NPKRFAAVIM RIREPKTTAL IFASGKMVVT GAKSEDDSKL ASRKYARIIQ KLGFNAKFT DFKIQNIVGS CDIKFPIRLE GLASKHHNFS SYEPELFPGL IYRMIKPKIV L LIFVSGKI VLTGAKVREE IYQAFEMIYP VLQDFRKV |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: Incubation with 1 mM ATP-gamma-S before SEC and before grid preparation. 0.05% beta-octyl glucoside added before blotting. | ||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 7 sec. / 前処理 - 雰囲気: AIR | ||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 283 K / 装置: LEICA EM GP 詳細: Incubation on the grid for 20 seconds before plunging.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 44.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)