+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
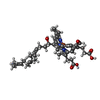
| タイトル | Respiratory Complex IV from S. cerevisiae | |||||||||
 マップデータ マップデータ | Monomeric mitochondrial complex IV (cytochrome c oxidase) isolated from S. cerevisiae. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Cytochrome C Oxidase / Mitochondria Respiratory Chain / Complex IV / Oxidoreductace-electron transport complex / OXIDOREDUCTASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報mitochondrial cytochrome c oxidase assembly / Mitochondrial protein degradation / cellular respiration / respiratory chain complex IV / cytochrome-c oxidase / mitochondrial electron transport, cytochrome c to oxygen / cytochrome-c oxidase activity / ubiquinone binding / ATP synthesis coupled electron transport / proton transmembrane transport ...mitochondrial cytochrome c oxidase assembly / Mitochondrial protein degradation / cellular respiration / respiratory chain complex IV / cytochrome-c oxidase / mitochondrial electron transport, cytochrome c to oxygen / cytochrome-c oxidase activity / ubiquinone binding / ATP synthesis coupled electron transport / proton transmembrane transport / aerobic respiration / respiratory electron transport chain / mitochondrial membrane / mitochondrial intermembrane space / oxidoreductase activity / mitochondrial inner membrane / copper ion binding / heme binding / mitochondrion / zinc ion binding / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.87 Å | |||||||||
 データ登録者 データ登録者 | Marechal A / Hartley A | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Biochim Biophys Acta Bioenerg / 年: 2022 ジャーナル: Biochim Biophys Acta Bioenerg / 年: 2022タイトル: Cryo-EM structure of a monomeric yeast S. cerevisiae complex IV isolated with maltosides: Implications in supercomplex formation. 著者: Gabriel Ing / Andrew M Hartley / Nikos Pinotsis / Amandine Maréchal /  要旨: In mitochondria, complex IV (CIV) can be found as a monomer, a dimer or in association with other respiratory complexes. The atomic structure of the yeast S. cerevisiae CIV in a supercomplex (SC) ...In mitochondria, complex IV (CIV) can be found as a monomer, a dimer or in association with other respiratory complexes. The atomic structure of the yeast S. cerevisiae CIV in a supercomplex (SC) with complex III (CIII) pointed to a region of significant conformational changes compared to the homologous mammalian CIV structures. These changes involved the matrix side domain of Cox5A at the CIII-CIV interface, and it was suggested that it could be required for SC formation. To investigate this, we solved the structure of the isolated monomeric CIV from S. cerevisiae stabilised in amphipol A8-35 at 3.9 Å using cryo-electron microscopy. Only a minor change in flexibility was seen in this Cox5A region, ruling out large CIV conformational shift for interaction with CIII and confirming the different fold of the yeast Cox5A subunit compared to mammalian homologues. Other differences in structure were the absence of two canonical subunits, Cox12 and Cox13, as well as Cox26, which is unique to the yeast CIV. Their absence is most likely due to the protein purification protocol used to isolate CIV from the III-IV SC. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14436.map.gz emd_14436.map.gz | 57.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14436-v30.xml emd-14436-v30.xml emd-14436.xml emd-14436.xml | 25.3 KB 25.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14436_fsc.xml emd_14436_fsc.xml | 8.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14436.png emd_14436.png | 143.1 KB | ||
| Filedesc metadata |  emd-14436.cif.gz emd-14436.cif.gz | 7.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14436 http://ftp.pdbj.org/pub/emdb/structures/EMD-14436 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14436 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14436 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14436_validation.pdf.gz emd_14436_validation.pdf.gz | 551.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14436_full_validation.pdf.gz emd_14436_full_validation.pdf.gz | 551.4 KB | 表示 | |
| XML形式データ |  emd_14436_validation.xml.gz emd_14436_validation.xml.gz | 11.2 KB | 表示 | |
| CIF形式データ |  emd_14436_validation.cif.gz emd_14436_validation.cif.gz | 14.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14436 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14436 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14436 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14436 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7z10MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14436.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14436.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Monomeric mitochondrial complex IV (cytochrome c oxidase) isolated from S. cerevisiae. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.815 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
+全体 : Cytochrome c oxidase
+超分子 #1: Cytochrome c oxidase
+超分子 #2: Cytochrome c oxidase
+分子 #1: Cytochrome c oxidase subunit 1
+分子 #2: Cytochrome c oxidase subunit 2
+分子 #3: CYTOCHROME C OXIDASE SUBUNIT 3; SYNONYM: CYTOCHROME C OXIDASE POL...
+分子 #4: Cytochrome c oxidase subunit 4, mitochondrial
+分子 #5: Cytochrome c oxidase polypeptide 5A, mitochondrial
+分子 #6: Cytochrome c oxidase subunit 6, mitochondrial
+分子 #7: CYTOCHROME C OXIDASE SUBUNIT 7; SYNONYM: CYTOCHROME C OXIDASE POL...
+分子 #8: Cytochrome c oxidase polypeptide VIII, mitochondrial
+分子 #9: CYTOCHROME C OXIDASE SUBUNIT 7A; SYNONYM: CYTOCHROME C OXIDASE PO...
+分子 #10: COPPER (II) ION
+分子 #11: HEME-A
+分子 #12: MAGNESIUM ION
+分子 #13: DI-PALMITOYL-3-SN-PHOSPHATIDYLETHANOLAMINE
+分子 #14: DINUCLEAR COPPER ION
+分子 #15: ZINC ION
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.2 |
|---|---|
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV 詳細: 3 microliters of sample applied to negatively glow discharged grig.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 48.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm 最小 デフォーカス(公称値): 1.4000000000000001 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)