+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
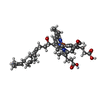
| Title | Respiratory Complex IV from S. cerevisiae | |||||||||
 Map data Map data | Monomeric mitochondrial complex IV (cytochrome c oxidase) isolated from S. cerevisiae. | |||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | Cytochrome C Oxidase / Mitochondria Respiratory Chain / Complex IV / Oxidoreductace-electron transport complex / OXIDOREDUCTASE | |||||||||
| Function / homology |  Function and homology information Function and homology informationmitochondrial respiratory chain complex IV assembly / Mitochondrial protein degradation / cellular respiration / respiratory chain complex IV / cytochrome-c oxidase / mitochondrial electron transport, cytochrome c to oxygen / cytochrome-c oxidase activity / ubiquinone binding / ATP synthesis coupled electron transport / proton transmembrane transport ...mitochondrial respiratory chain complex IV assembly / Mitochondrial protein degradation / cellular respiration / respiratory chain complex IV / cytochrome-c oxidase / mitochondrial electron transport, cytochrome c to oxygen / cytochrome-c oxidase activity / ubiquinone binding / ATP synthesis coupled electron transport / proton transmembrane transport / aerobic respiration / respiratory electron transport chain / mitochondrial intermembrane space / mitochondrial membrane / oxidoreductase activity / mitochondrial inner membrane / copper ion binding / heme binding / mitochondrion / zinc ion binding / metal ion binding Similarity search - Function | |||||||||
| Biological species |  | |||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 3.87 Å | |||||||||
 Authors Authors | Marechal A / Hartley A | |||||||||
| Funding support |  United Kingdom, 1 items United Kingdom, 1 items
| |||||||||
 Citation Citation |  Journal: Biochim Biophys Acta Bioenerg / Year: 2022 Journal: Biochim Biophys Acta Bioenerg / Year: 2022Title: Cryo-EM structure of a monomeric yeast S. cerevisiae complex IV isolated with maltosides: Implications in supercomplex formation. Authors: Gabriel Ing / Andrew M Hartley / Nikos Pinotsis / Amandine Maréchal /  Abstract: In mitochondria, complex IV (CIV) can be found as a monomer, a dimer or in association with other respiratory complexes. The atomic structure of the yeast S. cerevisiae CIV in a supercomplex (SC) ...In mitochondria, complex IV (CIV) can be found as a monomer, a dimer or in association with other respiratory complexes. The atomic structure of the yeast S. cerevisiae CIV in a supercomplex (SC) with complex III (CIII) pointed to a region of significant conformational changes compared to the homologous mammalian CIV structures. These changes involved the matrix side domain of Cox5A at the CIII-CIV interface, and it was suggested that it could be required for SC formation. To investigate this, we solved the structure of the isolated monomeric CIV from S. cerevisiae stabilised in amphipol A8-35 at 3.9 Å using cryo-electron microscopy. Only a minor change in flexibility was seen in this Cox5A region, ruling out large CIV conformational shift for interaction with CIII and confirming the different fold of the yeast Cox5A subunit compared to mammalian homologues. Other differences in structure were the absence of two canonical subunits, Cox12 and Cox13, as well as Cox26, which is unique to the yeast CIV. Their absence is most likely due to the protein purification protocol used to isolate CIV from the III-IV SC. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_14436.map.gz emd_14436.map.gz | 57.7 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-14436-v30.xml emd-14436-v30.xml emd-14436.xml emd-14436.xml | 25.3 KB 25.3 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_14436_fsc.xml emd_14436_fsc.xml | 8.9 KB | Display |  FSC data file FSC data file |
| Images |  emd_14436.png emd_14436.png | 143.1 KB | ||
| Filedesc metadata |  emd-14436.cif.gz emd-14436.cif.gz | 7.5 KB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14436 http://ftp.pdbj.org/pub/emdb/structures/EMD-14436 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14436 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14436 | HTTPS FTP |
-Related structure data
| Related structure data |  7z10MC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_14436.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_14436.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | Monomeric mitochondrial complex IV (cytochrome c oxidase) isolated from S. cerevisiae. | ||||||||||||||||||||||||||||||||||||
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.815 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
- Sample components
Sample components
+Entire : Cytochrome c oxidase
+Supramolecule #1: Cytochrome c oxidase
+Supramolecule #2: Cytochrome c oxidase
+Macromolecule #1: Cytochrome c oxidase subunit 1
+Macromolecule #2: Cytochrome c oxidase subunit 2
+Macromolecule #3: CYTOCHROME C OXIDASE SUBUNIT 3; SYNONYM: CYTOCHROME C OXIDASE POL...
+Macromolecule #4: Cytochrome c oxidase subunit 4, mitochondrial
+Macromolecule #5: Cytochrome c oxidase polypeptide 5A, mitochondrial
+Macromolecule #6: Cytochrome c oxidase subunit 6, mitochondrial
+Macromolecule #7: CYTOCHROME C OXIDASE SUBUNIT 7; SYNONYM: CYTOCHROME C OXIDASE POL...
+Macromolecule #8: Cytochrome c oxidase polypeptide VIII, mitochondrial
+Macromolecule #9: CYTOCHROME C OXIDASE SUBUNIT 7A; SYNONYM: CYTOCHROME C OXIDASE PO...
+Macromolecule #10: COPPER (II) ION
+Macromolecule #11: HEME-A
+Macromolecule #12: MAGNESIUM ION
+Macromolecule #13: DI-PALMITOYL-3-SN-PHOSPHATIDYLETHANOLAMINE
+Macromolecule #14: DINUCLEAR COPPER ION
+Macromolecule #15: ZINC ION
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Buffer | pH: 7.2 |
|---|---|
| Vitrification | Cryogen name: ETHANE / Instrument: FEI VITROBOT MARK IV Details: 3 microliters of sample applied to negatively glow discharged grig.. |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Image recording | Film or detector model: GATAN K2 SUMMIT (4k x 4k) / Average electron dose: 48.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | C2 aperture diameter: 70.0 µm / Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 3.0 µm / Nominal defocus min: 1.4000000000000001 µm |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
 Movie
Movie Controller
Controller






 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)