+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10721 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 2.85 A cryo-EM structure of the in vivo assembled type 1 pilus rod | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | FimA / pilus / monomer / subunit / pili / main structural subunit / high resolution / STRUCTURAL PROTEIN / cryo-EM / helical processing / RELION / Chaperone-usher pilus | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cell adhesion involved in single-species biofilm formation / pilus / cell adhesion / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
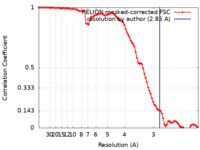
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.85 Å | |||||||||
 データ登録者 データ登録者 | Zyla D / Hospenthal M | |||||||||
| 資金援助 |  スイス, 2件 スイス, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: The assembly platform FimD is required to obtain the most stable quaternary structure of type 1 pili. 著者: Dawid S Zyla / Thomas Wiegand / Paul Bachmann / Rafal Zdanowicz / Christoph Giese / Beat H Meier / Gabriel Waksman / Manuela K Hospenthal / Rudi Glockshuber /     要旨: Type 1 pili are important virulence factors of uropathogenic Escherichia coli that mediate bacterial attachment to epithelial cells in the urinary tract. The pilus rod is comprised of thousands of ...Type 1 pili are important virulence factors of uropathogenic Escherichia coli that mediate bacterial attachment to epithelial cells in the urinary tract. The pilus rod is comprised of thousands of copies of the main structural subunit FimA and is assembled in vivo by the assembly platform FimD. Although type 1 pilus rods can self-assemble from FimA in vitro, this reaction is slower and produces structures with lower kinetic stability against denaturants compared to in vivo-assembled rods. Our study reveals that FimD-catalysed in vitro-assembled type 1 pilus rods attain a similar stability as pilus rods assembled in vivo. Employing structural, biophysical and biochemical analyses, we show that in vitro assembly reactions lacking FimD produce pilus rods with structural defects, reducing their stability against dissociation. Overall, our results indicate that FimD is not only required for the catalysis of pilus assembly, but also to control the assembly of the most stable quaternary structure. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10721.map.gz emd_10721.map.gz | 49.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10721-v30.xml emd-10721-v30.xml emd-10721.xml emd-10721.xml | 19.6 KB 19.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_10721_fsc.xml emd_10721_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_10721.png emd_10721.png | 80.8 KB | ||
| マスクデータ |  emd_10721_msk_1.map emd_10721_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-10721.cif.gz emd-10721.cif.gz | 6.3 KB | ||
| その他 |  emd_10721_additional_1.map.gz emd_10721_additional_1.map.gz emd_10721_half_map_1.map.gz emd_10721_half_map_1.map.gz emd_10721_half_map_2.map.gz emd_10721_half_map_2.map.gz | 4.5 MB 49.6 MB 49.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10721 http://ftp.pdbj.org/pub/emdb/structures/EMD-10721 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10721 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10721 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10721_validation.pdf.gz emd_10721_validation.pdf.gz | 1017.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10721_full_validation.pdf.gz emd_10721_full_validation.pdf.gz | 1017.2 KB | 表示 | |
| XML形式データ |  emd_10721_validation.xml.gz emd_10721_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  emd_10721_validation.cif.gz emd_10721_validation.cif.gz | 21.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10721 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10721 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10721 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10721 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10721.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_10721.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08187 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_10721_msk_1.map emd_10721_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_10721_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_10721_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_10721_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Type 1 pilus rod
| 全体 | 名称: Type 1 pilus rod |
|---|---|
| 要素 |
|
-超分子 #1: Type 1 pilus rod
| 超分子 | 名称: Type 1 pilus rod / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Type 1 pili recombinantly expressed, assembled in vivo and subsequently purified from the E. coli cell surface. |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 20.3 kDa/nm |
-分子 #1: Type-1 fimbrial protein, A chain
| 分子 | 名称: Type-1 fimbrial protein, A chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 18.121074 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKIKTLAIVV LSALSLSSTA ALAAATTVNG GTVHFKGEVV NAACAVDAGS VDQTVQLGQV RTASLAQEGA TSSAVGFNIQ LNDCDTNVA SKAAVAFLGT AIDAGHTNVL ALQSSAAGSA TNVGVQILDR TGAALTLDGA TFSSETTLNN GTNTIPFQAR Y FATGAATP GAANADATFK VQYQ UniProtKB: Type-1 fimbrial protein, A chain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 1.58 mg/mL |
|---|---|
| 緩衝液 | pH: 7 / 詳細: in ddH2O. |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 70 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: 3 ul sample, 30 s wait time, 0.5 s drain time, 6 s blotting. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 3469 / 平均露光時間: 8.0 sec. / 平均電子線量: 50.4 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)