+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-10409 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | In situ cryo-electron tomogram from Chlamydomonas reinhardtii of a proteasome cluster at the endoplasmic reticulum | |||||||||
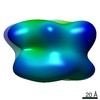
 マップデータ マップデータ | In situ cryo-electron tomogram from Chlamydomonas reinhardtii, showing a cluster of proteasomes at the ER membrane. | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  | |||||||||
| 手法 | 電子線トモグラフィー法 / クライオ電子顕微鏡法 | |||||||||
 データ登録者 データ登録者 | Albert S / Schaffer M / Baumeister W / Engel BD | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2020 ジャーナル: Proc Natl Acad Sci U S A / 年: 2020タイトル: Direct visualization of degradation microcompartments at the ER membrane. 著者: Sahradha Albert / Wojciech Wietrzynski / Chia-Wei Lee / Miroslava Schaffer / Florian Beck / Jan M Schuller / Patrice A Salomé / Jürgen M Plitzko / Wolfgang Baumeister / Benjamin D Engel /   要旨: To promote the biochemical reactions of life, cells can compartmentalize molecular interaction partners together within separated non-membrane-bound regions. It is unknown whether this strategy is ...To promote the biochemical reactions of life, cells can compartmentalize molecular interaction partners together within separated non-membrane-bound regions. It is unknown whether this strategy is used to facilitate protein degradation at specific locations within the cell. Leveraging in situ cryo-electron tomography to image the native molecular landscape of the unicellular alga , we discovered that the cytosolic protein degradation machinery is concentrated within ∼200-nm foci that contact specialized patches of endoplasmic reticulum (ER) membrane away from the ER-Golgi interface. These non-membrane-bound microcompartments exclude ribosomes and consist of a core of densely clustered 26S proteasomes surrounded by a loose cloud of Cdc48. Active proteasomes in the microcompartments directly engage with putative substrate at the ER membrane, a function canonically assigned to Cdc48. Live-cell fluorescence microscopy revealed that the proteasome clusters are dynamic, with frequent assembly and fusion events. We propose that the microcompartments perform ER-associated degradation, colocalizing the degradation machinery at specific ER hot spots to enable efficient protein quality control. #1:  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Direct visualization of degradation microcompartments at the ER membrane 著者: Albert S / Wietrzynski W / Lee CW / Schaffer M / Beck F / Schuller JM / Salome PA / Plitzko JM / Baumeister W / Engel BD | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_10409.map.gz emd_10409.map.gz | 337 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-10409-v30.xml emd-10409-v30.xml emd-10409.xml emd-10409.xml | 12.8 KB 12.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_10409.png emd_10409.png | 185.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-10409 http://ftp.pdbj.org/pub/emdb/structures/EMD-10409 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10409 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-10409 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_10409_validation.pdf.gz emd_10409_validation.pdf.gz | 217 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_10409_full_validation.pdf.gz emd_10409_full_validation.pdf.gz | 216.1 KB | 表示 | |
| XML形式データ |  emd_10409_validation.xml.gz emd_10409_validation.xml.gz | 3.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10409 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10409 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10409 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-10409 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_10409.map.gz / 形式: CCP4 / 大きさ: 762.2 MB / タイプ: IMAGE STORED AS SIGNED INTEGER (2 BYTES) ダウンロード / ファイル: emd_10409.map.gz / 形式: CCP4 / 大きさ: 762.2 MB / タイプ: IMAGE STORED AS SIGNED INTEGER (2 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | In situ cryo-electron tomogram from Chlamydomonas reinhardtii, showing a cluster of proteasomes at the ER membrane. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 13.68 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Whole Chlamydomonas cells
| 全体 | 名称: Whole Chlamydomonas cells |
|---|---|
| 要素 |
|
-超分子 #1: Whole Chlamydomonas cells
| 超分子 | 名称: Whole Chlamydomonas cells / タイプ: cell / ID: 1 / 親要素: 0 詳細: Grown suspended in TAP media, with normal atmosphere aeration and constant light |
|---|---|
| 由来(天然) | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 電子線トモグラフィー法 |
| 試料の集合状態 | cell |
- 試料調製
試料調製
| 緩衝液 | pH: 7 / 詳細: TAP media |
|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE-PROPANE / 装置: FEI VITROBOT MARK IV / 詳細: blotted from back for 10 seconds before plunging. |
| 切片作成 | 集束イオンビーム - 装置: OTHER / 集束イオンビーム - イオン: OTHER / 集束イオンビーム - 電圧: 30 kV / 集束イオンビーム - 電流: 0.03 nA / 集束イオンビーム - 時間: 2000 sec. / 集束イオンビーム - 温度: 95 K / 集束イオンビーム - Initial thickness: 1000 nm / 集束イオンビーム - 最終 厚さ: 150 nm 集束イオンビーム - 詳細: See https://bio-protocol.org/e1575 for detailed procedure.. The value given for _emd_sectioning_focused_ion_beam.instrument is FEI Quanta FIB. This is not in a list ...集束イオンビーム - 詳細: See https://bio-protocol.org/e1575 for detailed procedure.. The value given for _emd_sectioning_focused_ion_beam.instrument is FEI Quanta FIB. This is not in a list of allowed values set(['DB235', 'OTHER']) so OTHER is written into the XML file. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 詳細 | Bidirectional tilt scheme, separated at 0 degrees |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均露光時間: 1.5 sec. / 平均電子線量: 100.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 最大 デフォーカス(補正後): 5.6 µm / 最小 デフォーカス(補正後): 4.6 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 5.0 µm / 最小 デフォーカス(公称値): 5.0 µm / 倍率(公称値): 42000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | アルゴリズム: BACK PROJECTION / ソフトウェア - 名称:  IMOD / 使用した粒子像数: 60 IMOD / 使用した粒子像数: 60 |
|---|---|
| CTF補正 | ソフトウェア - 名称:  IMOD IMOD |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)

















