+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8xd0 | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
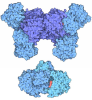
| タイトル | Cryo-EM structure of Glutamate dehydrogenase from Thermococcus profundus incorporating NADPH and AKG in the steady stage of reaction | |||||||||||||||||||||||||||||||||||||||||||||
 要素 要素 | Glutamate dehydrogenase | |||||||||||||||||||||||||||||||||||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / Complex / Coenzyme / NADPH / 2-oxoglutarate | |||||||||||||||||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報glutamate dehydrogenase [NAD(P)+] / glutamate dehydrogenase (NADP+) activity / glutamate dehydrogenase (NAD+) activity / amino acid metabolic process 類似検索 - 分子機能 | |||||||||||||||||||||||||||||||||||||||||||||
| 生物種 |   Thermococcus profundus (古細菌) Thermococcus profundus (古細菌) | |||||||||||||||||||||||||||||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.83 Å | |||||||||||||||||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Wakabayashi, T. / Oide, M. / Nakasako, M. | |||||||||||||||||||||||||||||||||||||||||||||
| 資金援助 |  日本, 14件 日本, 14件
| |||||||||||||||||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Sci Rep / 年: 2024 ジャーナル: Sci Rep / 年: 2024タイトル: CryoEM-sampling of metastable conformations appearing in cofactor-ligand association and catalysis of glutamate dehydrogenase. 著者: Taiki Wakabayashi / Mao Oide / Masayoshi Nakasako /  要旨: Kinetic aspects of enzymatic reactions are described by equations based on the Michaelis-Menten theory for the initial stage. However, the kinetic parameters provide little information on the atomic ...Kinetic aspects of enzymatic reactions are described by equations based on the Michaelis-Menten theory for the initial stage. However, the kinetic parameters provide little information on the atomic mechanism of the reaction. In this study, we analyzed structures of glutamate dehydrogenase in the initial and steady stages of the reaction using cryoEM at near-atomic resolution. In the initial stage, four metastable conformations displayed different domain motions and cofactor/ligand association modes. The most striking finding was that the enzyme-cofactor-substrate complex, treated as a single state in the enzyme kinetic theory, comprised at least three different metastable conformations. In the steady stage, seven conformations, including derivatives from the four conformations in the initial stage, made the reaction pathway complicated. Based on the visualized conformations, we discussed stage-dependent pathways to illustrate the dynamics of the enzyme in action. | |||||||||||||||||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8xd0.cif.gz 8xd0.cif.gz | 87.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8xd0.ent.gz pdb8xd0.ent.gz | 63.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8xd0.json.gz 8xd0.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8xd0_validation.pdf.gz 8xd0_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8xd0_full_validation.pdf.gz 8xd0_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  8xd0_validation.xml.gz 8xd0_validation.xml.gz | 29.3 KB | 表示 | |
| CIF形式データ |  8xd0_validation.cif.gz 8xd0_validation.cif.gz | 41 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/xd/8xd0 https://data.pdbj.org/pub/pdb/validation_reports/xd/8xd0 ftp://data.pdbj.org/pub/pdb/validation_reports/xd/8xd0 ftp://data.pdbj.org/pub/pdb/validation_reports/xd/8xd0 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  38261MC  8xcoC  8xcpC  8xcqC  8xcrC  8xcsC  8xctC  8xcuC  8xcvC  8xcwC  8xcxC  8xcyC  8xczC  8xd1C  8xd2C  8xd3C  8xd4C  8xd5C  8xd6C M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 46758.477 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Thermococcus profundus (古細菌) / 遺伝子: gdhA / 発現宿主: Thermococcus profundus (古細菌) / 遺伝子: gdhA / 発現宿主:  |
|---|---|
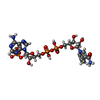
| #2: 化合物 | ChemComp-NDP / |
| #3: 化合物 | ChemComp-AKG / |
| #4: 水 | ChemComp-HOH / |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Hexamer of glutamate dehydrogenase in the presence of NADP and glutamate タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.280 MDa / 実験値: YES | ||||||||||||||||||||
| 由来(天然) | 生物種:   Thermococcus profundus (古細菌) Thermococcus profundus (古細菌) | ||||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 4.8 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 281 K 詳細: The sample solution kept at room temperature was flash-frozen 1-h after mixing GDH, NADP and glutamate solutions. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: JEOL CRYO ARM 300 詳細: Grid information as following: Company/model: Quantifoil Cu 1.2/1.3 Material:Cu Grid mesh: 200 |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 47000 nm / 最小 デフォーカス(公称値): 400 nm |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 電子線照射量: 1 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 7075 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 6334528 詳細: Auto-picking based on templates from manually picked GDH particles. | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.83 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 113612 / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT | ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





















 PDBj
PDBj