+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8d9d | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human DNA polymerase-alpha/primase elongation complex II bound to primer/template | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | REPLICATION / DNA replication / human DNA polymerase alpha/primase / human primosome / elongation complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of DNA primase activity / DNA primase AEP / ribonucleotide binding / DNA replication initiation / DNA/RNA hybrid binding / Telomere C-strand synthesis initiation / Inhibition of replication initiation of damaged DNA by RB1/E2F1 / alpha DNA polymerase:primase complex / Polymerase switching / regulation of type I interferon production ...positive regulation of DNA primase activity / DNA primase AEP / ribonucleotide binding / DNA replication initiation / DNA/RNA hybrid binding / Telomere C-strand synthesis initiation / Inhibition of replication initiation of damaged DNA by RB1/E2F1 / alpha DNA polymerase:primase complex / Polymerase switching / regulation of type I interferon production / Processive synthesis on the lagging strand / DNA primase activity / Removal of the Flap Intermediate / Polymerase switching on the C-strand of the telomere / lagging strand elongation / DNA replication, synthesis of primer / mitotic DNA replication initiation / DNA strand elongation involved in DNA replication / DNA synthesis involved in DNA repair / G1/S-Specific Transcription / leading strand elongation / DNA replication origin binding / Activation of the pre-replicative complex / DNA replication initiation / Defective pyroptosis / nuclear matrix / double-strand break repair via nonhomologous end joining / protein import into nucleus / nuclear envelope / single-stranded DNA binding / 4 iron, 4 sulfur cluster binding / DNA replication / DNA-directed DNA polymerase / DNA-directed DNA polymerase activity / DNA repair / nucleotide binding / chromatin binding / chromatin / nucleolus / protein kinase binding / magnesium ion binding / DNA binding / zinc ion binding / nucleoplasm / membrane / nucleus / metal ion binding / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.59 Å | |||||||||
 データ登録者 データ登録者 | He, Q. / Baranovskiy, A. / Lim, C. / Tahirov, T. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2023 ジャーナル: Nat Struct Mol Biol / 年: 2023タイトル: Structures of human primosome elongation complexes. 著者: Qixiang He / Andrey G Baranovskiy / Lucia M Morstadt / Alisa E Lisova / Nigar D Babayeva / Benjamin L Lusk / Ci Ji Lim / Tahir H Tahirov /  要旨: The synthesis of RNA-DNA primer by primosome requires coordination between primase and DNA polymerase α subunits, which is accompanied by unknown architectural rearrangements of multiple domains. ...The synthesis of RNA-DNA primer by primosome requires coordination between primase and DNA polymerase α subunits, which is accompanied by unknown architectural rearrangements of multiple domains. Using cryogenic electron microscopy, we solved a 3.6 Å human primosome structure caught at an early stage of RNA primer elongation with deoxynucleotides. The structure confirms a long-standing role of primase large subunit and reveals new insights into how primosome is limited to synthesizing short RNA-DNA primers. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8d9d.cif.gz 8d9d.cif.gz | 458.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8d9d.ent.gz pdb8d9d.ent.gz | 354.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8d9d.json.gz 8d9d.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8d9d_validation.pdf.gz 8d9d_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8d9d_full_validation.pdf.gz 8d9d_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  8d9d_validation.xml.gz 8d9d_validation.xml.gz | 72.7 KB | 表示 | |
| CIF形式データ |  8d9d_validation.cif.gz 8d9d_validation.cif.gz | 111.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d9/8d9d https://data.pdbj.org/pub/pdb/validation_reports/d9/8d9d ftp://data.pdbj.org/pub/pdb/validation_reports/d9/8d9d ftp://data.pdbj.org/pub/pdb/validation_reports/d9/8d9d | HTTPS FTP |
-関連構造データ
| 関連構造データ | 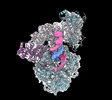 27258MC  8d96C C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 2分子 AB
| #1: タンパク質 | 分子量: 49981.012 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRIM1 Homo sapiens (ヒト) / 遺伝子: PRIM1発現宿主:  参照: UniProt: P49642, DNA primase AEP |
|---|---|
| #2: タンパク質 | 分子量: 58890.918 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRIM2, PRIM2A Homo sapiens (ヒト) / 遺伝子: PRIM2, PRIM2A発現宿主:  参照: UniProt: P49643 |
-DNA polymerase alpha ... , 2種, 2分子 CD
| #3: タンパク質 | 分子量: 166131.094 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: POLA1, POLA Homo sapiens (ヒト) / 遺伝子: POLA1, POLA発現宿主:  参照: UniProt: P09884, DNA-directed DNA polymerase |
|---|---|
| #4: タンパク質 | 分子量: 49074.590 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: POLA2 Homo sapiens (ヒト) / 遺伝子: POLA2発現宿主:  参照: UniProt: Q14181 |
-DNA/RNAハイブリッド / DNA鎖 , 2種, 2分子 EF
| #5: DNA/RNAハイブリッド | 分子量: 3977.352 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|---|
| #6: DNA鎖 | 分子量: 5829.786 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-非ポリマー , 4種, 7分子 






| #7: 化合物 | | #8: 化合物 | ChemComp-SF4 / | #9: 化合物 | #10: 化合物 | ChemComp-DTP / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Elongation complex II of human DNA polymerase alpha/primase bound to RNA-DNA primer and DNA template タイプ: COMPLEX 詳細: Larger elongation complex solved using cryo-EM single-particle analysis Entity ID: #1-#6 / 由来: MULTIPLE SOURCES | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.340 MDa / 実験値: YES | ||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  細胞: combined with SF21 cells | ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 詳細: CHAPSO is made fresh at 80 mM before added to the sample at a final concentration of 4-8 mM immediately before vitrification. | ||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||
| 試料 | 濃度: 6 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: This sample was monodisperse | ||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 95 % / 凍結前の試料温度: 277.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: SPOT SCAN |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1000 nm |
| 撮影 | 電子線照射量: 50 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 2 / 実像数: 13243 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / 分類: 精密化 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| |||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2522283 | |||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | |||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.59 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 199286 / 対称性のタイプ: POINT | |||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT | |||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Source name: PDB / タイプ: experimental model
| |||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj





















































