+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8cyi | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structures and computational analysis for enhanced potency in MTA-synergic inhibition of human protein arginine methyltransferase 5 | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | ONCOPROTEIN/Transferase / PRMT5 / protein arginine methyl transferase / MTA-inhibitor synergy / cryo-EM structure-based drug design / computational analysis / catalytic mechanism / drug discovery / docking analysis / ONCOPROTEIN / ONCOPROTEIN-Transferase complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of adenylate cyclase-inhibiting dopamine receptor signaling pathway / peptidyl-arginine N-methylation / oocyte axis specification / type II protein arginine methyltransferase / protein-arginine omega-N symmetric methyltransferase activity / peptidyl-arginine methylation / Golgi ribbon formation / negative regulation of epithelial cell proliferation involved in prostate gland development / histone H4R3 methyltransferase activity / secretory columnal luminar epithelial cell differentiation involved in prostate glandular acinus development ...positive regulation of adenylate cyclase-inhibiting dopamine receptor signaling pathway / peptidyl-arginine N-methylation / oocyte axis specification / type II protein arginine methyltransferase / protein-arginine omega-N symmetric methyltransferase activity / peptidyl-arginine methylation / Golgi ribbon formation / negative regulation of epithelial cell proliferation involved in prostate gland development / histone H4R3 methyltransferase activity / secretory columnal luminar epithelial cell differentiation involved in prostate glandular acinus development / histone arginine N-methyltransferase activity / epithelial cell proliferation involved in prostate gland development / protein-arginine N-methyltransferase activity / methylosome / methyl-CpG binding / endothelial cell activation / histone H3 methyltransferase activity / positive regulation of mRNA splicing, via spliceosome / negative regulation of gene expression via chromosomal CpG island methylation / Cul4B-RING E3 ubiquitin ligase complex / regulation of mitotic nuclear division / histone methyltransferase complex / positive regulation of oligodendrocyte differentiation / histone methyltransferase activity / E-box binding / negative regulation of cell differentiation / ubiquitin-like ligase-substrate adaptor activity / ribonucleoprotein complex binding / spliceosomal snRNP assembly / regulation of ERK1 and ERK2 cascade / nuclear receptor coactivator activity / regulation of signal transduction by p53 class mediator / methyltransferase activity / liver regeneration / DNA-templated transcription termination / circadian regulation of gene expression / Regulation of TP53 Activity through Methylation / RMTs methylate histone arginines / protein polyubiquitination / transcription corepressor activity / p53 binding / snRNP Assembly / ubiquitin-dependent protein catabolic process / chromatin remodeling / protein heterodimerization activity / positive regulation of cell population proliferation / chromatin / regulation of DNA-templated transcription / regulation of transcription by RNA polymerase II / Golgi apparatus / nucleoplasm / identical protein binding / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.14 Å | ||||||
 データ登録者 データ登録者 | Yadav, G.P. / Wei, Z. / Xiaozhi, Y. / Chenglong, L. / Jiang, Q. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
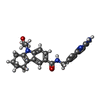
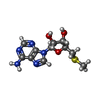
 引用 引用 |  ジャーナル: Commun Biol / 年: 2022 ジャーナル: Commun Biol / 年: 2022タイトル: Cryo-EM structure-based selection of computed ligand poses enables design of MTA-synergic PRMT5 inhibitors of better potency. 著者: Wei Zhou / Gaya P Yadav / Xiaozhi Yang / Feng Qin / Chenglong Li / Qiu-Xing Jiang /  要旨: Projected potential of 2.5-4.0 Å cryo-EM structures for structure-based drug design is not well realized yet. Here we show that a 3.1 Å structure of PRMT5 is suitable for selecting computed ...Projected potential of 2.5-4.0 Å cryo-EM structures for structure-based drug design is not well realized yet. Here we show that a 3.1 Å structure of PRMT5 is suitable for selecting computed poses of a chemical inhibitor and its analogs for enhanced potency. PRMT5, an oncogenic target for various cancer types, has many inhibitors manifesting little cooperativity with MTA, a co-factor analog accumulated in MTAP-/- cells. To achieve MTA-synergic inhibition, a pharmacophore from virtual screen leads to a specific inhibitor (11-2 F). Cryo-EM structures of 11-2 F / MTA-bound human PRMT5/MEP50 complex and its apo form resolved at 3.1 and 3.2 Å respectively show that 11-2 F in the catalytic pocket shifts the cofactor-binding pocket away by ~2.0 Å, contributing to positive cooperativity. Computational analysis predicts subtype specificity of 11-2 F among PRMTs. Structural analysis of ligands in the binding pockets is performed to compare poses of 11-2 F and its redesigned analogs and identifies three new analogs predicted to have significantly better potency. One of them, after synthesis, is ~4 fold more efficient in inhibiting PRMT5 catalysis than 11-2 F, with strong MTA-synergy. These data suggest the feasibility of employing near-atomic resolution cryo-EM structures and computational analysis of ligand poses for small molecule therapeutics. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8cyi.cif.gz 8cyi.cif.gz | 315.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8cyi.ent.gz pdb8cyi.ent.gz | 254.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8cyi.json.gz 8cyi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8cyi_validation.pdf.gz 8cyi_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8cyi_full_validation.pdf.gz 8cyi_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  8cyi_validation.xml.gz 8cyi_validation.xml.gz | 36.6 KB | 表示 | |
| CIF形式データ |  8cyi_validation.cif.gz 8cyi_validation.cif.gz | 53.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/cy/8cyi https://data.pdbj.org/pub/pdb/validation_reports/cy/8cyi ftp://data.pdbj.org/pub/pdb/validation_reports/cy/8cyi ftp://data.pdbj.org/pub/pdb/validation_reports/cy/8cyi | HTTPS FTP |
-関連構造データ
| 関連構造データ |  27078MC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 72766.664 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1 Homo sapiens (ヒト) / 遺伝子: PRMT5, HRMT1L5, IBP72, JBP1, SKB1発現宿主:  参照: UniProt: O14744, type II protein arginine methyltransferase |
|---|---|
| #2: タンパク質 | 分子量: 33226.211 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: WDR77, MEP50, WD45, HKMT1069, Nbla10071 Homo sapiens (ヒト) / 遺伝子: WDR77, MEP50, WD45, HKMT1069, Nbla10071発現宿主:  参照: UniProt: Q9BQA1 |
| #3: 化合物 | ChemComp-P2R / |
| #4: 化合物 | ChemComp-MTA / |
| 研究の焦点であるリガンドがあるか | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Complex of PRMT5 and MEP50 in the presence of MTA and a novel inhibitor (11-2F) タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: .440 MDa / 実験値: YES |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 0.4 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | 詳細: Preclean plasma cleaner / グリッドの材料: COPPER / グリッドのサイズ: 200 divisions/in. / グリッドのタイプ: Quantifoil R2/2 |
| 急速凍結 | 装置: FEI VITROBOT MARK III / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: DARK FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1500 nm / Cs: 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 40 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 4115 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 866240 | ||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: D2 (2回x2回 2面回転対称) | ||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.14 Å / 粒子像の数: 207392 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 68 / プロトコル: OTHER / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 最高解像度: 3.14 Å |
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj