+ データを開く
データを開く
- 基本情報
基本情報
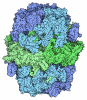
| 登録情報 | データベース: PDB / ID: 8brj | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Escherichia coli anaerobic fatty acid beta oxidation trifunctional enzyme (anEcTFE) trimeric complex | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / complex / heterotrimer | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報fatty acid beta-oxidation, unsaturated, even number / fatty acid beta-oxidation multienzyme complex / 3-hydroxybutyryl-CoA epimerase / 3-hydroxybutyryl-CoA epimerase activity / acetyl-CoA C-acyltransferase / acetyl-CoA C-acyltransferase activity / long-chain-3-hydroxyacyl-CoA dehydrogenase activity / 3-hydroxyacyl-CoA dehydrogenase / enoyl-CoA hydratase / acetyl-CoA C-acetyltransferase activity ...fatty acid beta-oxidation, unsaturated, even number / fatty acid beta-oxidation multienzyme complex / 3-hydroxybutyryl-CoA epimerase / 3-hydroxybutyryl-CoA epimerase activity / acetyl-CoA C-acyltransferase / acetyl-CoA C-acyltransferase activity / long-chain-3-hydroxyacyl-CoA dehydrogenase activity / 3-hydroxyacyl-CoA dehydrogenase / enoyl-CoA hydratase / acetyl-CoA C-acetyltransferase activity / 3-hydroxyacyl-CoA dehydrogenase activity / enoyl-CoA hydratase activity / fatty acid beta-oxidation / NAD+ binding / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.08 Å | ||||||||||||
 データ登録者 データ登録者 | Sah-Teli, S.K. / Pinkas, M. / Novacek, J. / Venkatesan, R. | ||||||||||||
| 資金援助 |  チェコ, チェコ,  フィンランド, European Union, 3件 フィンランド, European Union, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: Structural basis for different membrane-binding properties of E. coli anaerobic and human mitochondrial β-oxidation trifunctional enzymes. 著者: Shiv K Sah-Teli / Matyas Pinkas / Mikko J Hynönen / Sarah J Butcher / Rik K Wierenga / Jiri Novacek / Rajaram Venkatesan /   要旨: Facultative anaerobic bacteria such as Escherichia coli have two αβ heterotetrameric trifunctional enzymes (TFE), catalyzing the last three steps of the β-oxidation cycle: soluble aerobic TFE ...Facultative anaerobic bacteria such as Escherichia coli have two αβ heterotetrameric trifunctional enzymes (TFE), catalyzing the last three steps of the β-oxidation cycle: soluble aerobic TFE (EcTFE) and membrane-associated anaerobic TFE (anEcTFE), closely related to the human mitochondrial TFE (HsTFE). The cryo-EM structure of anEcTFE and crystal structures of anEcTFE-α show that the overall assembly of anEcTFE and HsTFE is similar. However, their membrane-binding properties differ considerably. The shorter A5-H7 and H8 regions of anEcTFE-α result in weaker α-β as well as α-membrane interactions, respectively. The protruding H-H region of anEcTFE-β is therefore more critical for membrane-association. Mutational studies also show that this region is important for the stability of the anEcTFE-β dimer and anEcTFE heterotetramer. The fatty acyl tail binding tunnel of the anEcTFE-α hydratase domain, as in HsTFE-α, is wider than in EcTFE-α, accommodating longer fatty acyl tails, in good agreement with their respective substrate specificities. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8brj.cif.gz 8brj.cif.gz | 304.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8brj.ent.gz pdb8brj.ent.gz | 238.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8brj.json.gz 8brj.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8brj_validation.pdf.gz 8brj_validation.pdf.gz | 1.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8brj_full_validation.pdf.gz 8brj_full_validation.pdf.gz | 1.5 MB | 表示 | |
| XML形式データ |  8brj_validation.xml.gz 8brj_validation.xml.gz | 63.3 KB | 表示 | |
| CIF形式データ |  8brj_validation.cif.gz 8brj_validation.cif.gz | 92.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/br/8brj https://data.pdbj.org/pub/pdb/validation_reports/br/8brj ftp://data.pdbj.org/pub/pdb/validation_reports/br/8brj ftp://data.pdbj.org/pub/pdb/validation_reports/br/8brj | HTTPS FTP |
-関連構造データ
| 関連構造データ |  16217MC  8bnrC  8bnuC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 48202.070 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  発現宿主:  参照: UniProt: P76503, acetyl-CoA C-acyltransferase #2: タンパク質 | | 分子量: 77169.125 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  発現宿主:  参照: UniProt: P77399, enoyl-CoA hydratase, 3-hydroxybutyryl-CoA epimerase, 3-hydroxyacyl-CoA dehydrogenase |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: anEcTFE trimer / タイプ: COMPLEX / 詳細: heterotrimeric complex / Entity ID: all / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 8 詳細: 50 mM Tris, 500 mM NaCl, 5% glycerol, 2.5 mM DTT, 0.0033% amphipol A8-35, pH 8 |
| 試料 | 濃度: 0.1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: C-flat-1.2/1.3 |
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277.15 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1200 nm / Cs: 2.7 mm / C2レンズ絞り径: 30 µm / アライメント法: ZEMLIN TABLEAU |
| 撮影 | 平均露光時間: 5 sec. / 電子線照射量: 48 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 撮影したグリッド数: 3 / 実像数: 18669 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 10 eV |
| 画像スキャン | サンプリングサイズ: 5 µm / 横: 3838 / 縦: 3710 / 動画フレーム数/画像: 40 |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.2_4158: / 分類: 精密化 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 4.08 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 37357 / アルゴリズム: FOURIER SPACE / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | 空間: REAL / Target criteria: cross-correlation coefficient | ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj