+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8at5 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | native Coxsackievirus A9 | ||||||
 要素 要素 | (Capsid protein ...) x 4 | ||||||
 キーワード キーワード | VIRUS / icosahedral symmetry / intact virion / picornavirus | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport ...symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport / DNA replication / RNA helicase activity / endocytosis involved in viral entry into host cell / symbiont-mediated activation of host autophagy / RNA-directed RNA polymerase / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / DNA-templated transcription / virion attachment to host cell / host cell nucleus / structural molecule activity / ATP hydrolysis activity / proteolysis / RNA binding / zinc ion binding / ATP binding / membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  Human coxsackievirus A9 (コクサッキーウイルス) Human coxsackievirus A9 (コクサッキーウイルス) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | ||||||
 データ登録者 データ登録者 | Domanska, A. / Plavec, Z. / Ruokolainen, V. / Marjomaki, V.S. / Butcher, S.J. | ||||||
| 資金援助 |  フィンランド, 1件 フィンランド, 1件
| ||||||
 引用 引用 |  ジャーナル: J Virol / 年: 2022 ジャーナル: J Virol / 年: 2022タイトル: Structural Studies Reveal that Endosomal Cations Promote Formation of Infectious Coxsackievirus A9 A-Particles, Facilitating RNA and VP4 Release. 著者: Aušra Domanska / Zlatka Plavec / Visa Ruokolainen / Benita Löflund / Varpu Marjomäki / Sarah J Butcher /  要旨: Coxsackievirus A9 (CVA9), an enterovirus, is a common cause of pediatric aseptic meningitis and neonatal sepsis. During cell entry, enterovirus capsids undergo conformational changes leading to ...Coxsackievirus A9 (CVA9), an enterovirus, is a common cause of pediatric aseptic meningitis and neonatal sepsis. During cell entry, enterovirus capsids undergo conformational changes leading to expansion, formation of large pores, externalization of VP1 N termini, and loss of the lipid factor from VP1. Factors such as receptor binding, heat, and acidic pH can trigger capsid expansion in some enteroviruses. Here, we show that fatty acid-free bovine serum albumin or neutral endosomal ionic conditions can independently prime CVA9 for expansion and genome release. Our results showed that CVA9 treatment with albumin or endosomal ions generated a heterogeneous population of virions, which could be physically separated by asymmetric flow field flow fractionation and computationally by cryo-electron microscopy (cryo-EM) and image processing. We report cryo-EM structures of CVA9 A-particles obtained by albumin or endosomal ion treatment and a control nonexpanded virion to 3.5, 3.3, and 2.9 Å resolution, respectively. Whereas albumin promoted stable expanded virions, the endosomal ionic concentrations induced unstable CVA9 virions which easily disintegrated, losing their genome. Loss of most of the VP4 molecules and exposure of negatively charged amino acid residues in the capsid's interior after expansion created a repulsive viral RNA-capsid interface, aiding genome release. Coxsackievirus A9 (CVA9) is a common cause of meningitis and neonatal sepsis. The triggers and mode of action of RNA release into the cell unusually do not require receptor interaction. Rather, a slow process in the endosome, independent of low pH, is required. Here, we show by biophysical separation, cryogenic electron microscopy, and image reconstruction that albumin and buffers mimicking the endosomal ion composition can separately and together expand and prime CVA9 for uncoating. Furthermore, we show in these expanded particles that VP4 is present at only ~10% of the occupancy found in the virion, VP1 is externalized, and the genome is repelled by the negatively charged, repulsive inner surface of the capsid that occurs due to the expansion. Thus, we can now link observations from cell biology of infection with the physical processes that occur in the capsid to promote genome uncoating. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8at5.cif.gz 8at5.cif.gz | 287.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8at5.ent.gz pdb8at5.ent.gz | 229.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8at5.json.gz 8at5.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/at/8at5 https://data.pdbj.org/pub/pdb/validation_reports/at/8at5 ftp://data.pdbj.org/pub/pdb/validation_reports/at/8at5 ftp://data.pdbj.org/pub/pdb/validation_reports/at/8at5 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  15634MC  8aw6C  8axxC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 実験データセット #1 | データ参照:  10.6019/EMPIAR-11386 / データの種類: EMPIAR 10.6019/EMPIAR-11386 / データの種類: EMPIAR |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | x 60
|
- 要素
要素
-Capsid protein ... , 4種, 4分子 DABC
| #1: タンパク質 | 分子量: 7352.039 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: Viral protein 4, VP4 由来: (天然)  Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス)株: Griggs / 参照: UniProt: P21404 |
|---|---|
| #2: タンパク質 | 分子量: 33869.020 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: Viral protein 1, VP1 由来: (天然)  Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス)細胞株: GMK / 器官: kidney / 株: Griggs / 参照: UniProt: P21404 |
| #3: タンパク質 | 分子量: 28885.518 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: Viral protein 2, VP2 由来: (天然)  Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス)株: Griggs / 参照: UniProt: P21404 |
| #4: タンパク質 | 分子量: 26335.072 Da / 分子数: 1 / 由来タイプ: 天然 / 詳細: Viral protein 3, VP3 由来: (天然)  Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス)株: Griggs / 参照: UniProt: P21404 |
-非ポリマー , 2種, 2分子 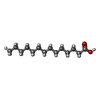


| #5: 化合物 | ChemComp-MYR / |
|---|---|
| #6: 化合物 | ChemComp-PLM / |
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Coxsackievirus A9 / タイプ: VIRUS / Entity ID: #2-#4, #1 / 由来: NATURAL |
|---|---|
| 分子量 | 値: 8 MDa / 実験値: NO |
| 由来(天然) | 生物種:  Coxsackievirus A9 (コクサッキーウイルス) Coxsackievirus A9 (コクサッキーウイルス) |
| ウイルスについての詳細 | 中空か: NO / エンベロープを持つか: NO / 単離: STRAIN / タイプ: VIRION |
| 天然宿主 | 生物種: Homo sapiens |
| ウイルス殻 | 名称: icosahedral / 直径: 300 nm / 三角数 (T数): 1 |
| 緩衝液 | pH: 7.25 / 詳細: PBS containing 2mM MgCl2, pH 7.2 |
| 試料 | 濃度: 0.1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: this sample was monodisperse |
| 試料支持 | グリッドの材料: COPPER / グリッドのタイプ: Quantifoil R1.2/1.3 |
| 急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 150000 X / 最大 デフォーカス(公称値): 1800 nm / 最小 デフォーカス(公称値): 800 nm |
| 撮影 | 電子線照射量: 30 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: FEI FALCON III (4k x 4k) |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 28818 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: I (正20面体型対称) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 21365 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 1D4M Accession code: 1D4M / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 73.2 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj












