+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7vvu | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | NuA4 HAT module bound to the nucleosome | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | DNA BINDING PROTEIN/DNA / NuA4 nucleosome / DNA BINDING PROTEIN / DNA BINDING PROTEIN-DNA complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報PI5P Regulates TP53 Acetylation / : / piccolo histone acetyltransferase complex / SUMOylation of transcription cofactors / NuA4 histone acetyltransferase complex / positive regulation of macroautophagy / histone acetyltransferase complex / histone acetyltransferase activity / histone acetyltransferase / methylated histone binding ...PI5P Regulates TP53 Acetylation / : / piccolo histone acetyltransferase complex / SUMOylation of transcription cofactors / NuA4 histone acetyltransferase complex / positive regulation of macroautophagy / histone acetyltransferase complex / histone acetyltransferase activity / histone acetyltransferase / methylated histone binding / meiotic cell cycle / structural constituent of chromatin / nucleosome / chromatin organization / chromatin remodeling / cell cycle / protein heterodimerization activity / DNA repair / DNA-templated transcription / regulation of DNA-templated transcription / regulation of transcription by RNA polymerase II / DNA binding / nucleus / metal ion binding / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | ||||||
 データ登録者 データ登録者 | Chen, Z. / Qu, K. | ||||||
| 資金援助 | 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Structure of the NuA4 acetyltransferase complex bound to the nucleosome. 著者: Keke Qu / Kangjing Chen / Hao Wang / Xueming Li / Zhucheng Chen /  要旨: Deoxyribonucleic acid in eukaryotes wraps around the histone octamer to form nucleosomes, the fundamental unit of chromatin. The N termini of histone H4 interact with nearby nucleosomes and play an ...Deoxyribonucleic acid in eukaryotes wraps around the histone octamer to form nucleosomes, the fundamental unit of chromatin. The N termini of histone H4 interact with nearby nucleosomes and play an important role in the formation of high-order chromatin structure and heterochromatin silencing. NuA4 in yeast and its homologue Tip60 complex in mammalian cells are the key enzymes that catalyse H4 acetylation, which in turn regulates chromatin packaging and function in transcription activation and DNA repair. Here we report the cryo-electron microscopy structure of NuA4 from Saccharomyces cerevisiae bound to the nucleosome. NuA4 comprises two major modules: the catalytic histone acetyltransferase (HAT) module and the transcription activator-binding (TRA) module. The nucleosome is mainly bound by the HAT module and is positioned close to a polybasic surface of the TRA module, which is important for the optimal activity of NuA4. The nucleosomal linker DNA carrying the upstream activation sequence is oriented towards the conserved, transcription activator-binding surface of the Tra1 subunit, which suggests a potential mechanism of NuA4 to act as a transcription co-activator. The HAT module recognizes the disk face of the nucleosome through the H2A-H2B acidic patch and nucleosomal DNA, projecting the catalytic pocket of Esa1 to the N-terminal tail of H4 and supporting its function in selective acetylation of H4. Together, our findings illustrate how NuA4 is assembled and provide mechanistic insights into nucleosome recognition and transcription co-activation by a HAT. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7vvu.cif.gz 7vvu.cif.gz | 575.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7vvu.ent.gz pdb7vvu.ent.gz | 412.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7vvu.json.gz 7vvu.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7vvu_validation.pdf.gz 7vvu_validation.pdf.gz | 864.1 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7vvu_full_validation.pdf.gz 7vvu_full_validation.pdf.gz | 889.8 KB | 表示 | |
| XML形式データ |  7vvu_validation.xml.gz 7vvu_validation.xml.gz | 56.4 KB | 表示 | |
| CIF形式データ |  7vvu_validation.cif.gz 7vvu_validation.cif.gz | 88.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/vv/7vvu https://data.pdbj.org/pub/pdb/validation_reports/vv/7vvu ftp://data.pdbj.org/pub/pdb/validation_reports/vv/7vvu ftp://data.pdbj.org/pub/pdb/validation_reports/vv/7vvu | HTTPS FTP |
-関連構造データ
| 関連構造データ |  32148MC  7vvyC  7vvzC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Chromatin modification-related protein ... , 2種, 2分子 YV
| #1: タンパク質 | 分子量: 12915.704 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|---|
| #2: タンパク質 | 分子量: 32139.514 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
-タンパク質 , 6種, 11分子 TXOAQBSNUDP
| #3: タンパク質 | 分子量: 96889.867 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  #4: タンパク質 | 分子量: 15435.126 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現) 発現宿主:  #5: タンパク質 | 分子量: 11394.426 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現) 発現宿主:  #6: タンパク質 | 分子量: 14109.436 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現) 発現宿主:  #7: タンパク質 | 分子量: 13965.265 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現) 発現宿主:  #8: タンパク質 | | 分子量: 52692.844 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
|---|
-DNA鎖 , 2種, 2分子 WI
| #9: DNA鎖 | 分子量: 63679.512 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  |
|---|---|
| #10: DNA鎖 | 分子量: 64150.809 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)  |
-非ポリマー , 1種, 1分子 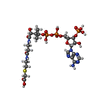
| #11: 化合物 | ChemComp-CMC / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: complex of NuA4 HAT module and nucleosome / タイプ: COMPLEX / Entity ID: #1-#10 / 由来: MULTIPLE SOURCES |
|---|---|
| 由来(天然) | 生物種:  |
| 緩衝液 | pH: 7.6 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: NITROGEN |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: OTHER / 最大 デフォーカス(公称値): 1800 nm / 最小 デフォーカス(公称値): 1200 nm |
| 撮影 | 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| CTF補正 | タイプ: NONE |
|---|---|
| 3次元再構成 | 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 393016 / 対称性のタイプ: POINT |
 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj









































