+ データを開く
データを開く
- 基本情報
基本情報
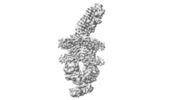
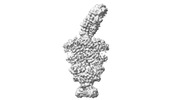
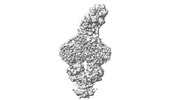
| 登録情報 | データベース: PDB / ID: 7qba | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the ABC transporter NosDFY complexed with nitrous oxide reductase NosZ | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / ABC transporter / metal binding protein / nitrous oxide reductase | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nitrous-oxide reductase / nitrous-oxide reductase activity / copper ion import / denitrification pathway / cytochrome-c oxidase activity / ABC-type transporter activity / periplasmic space / copper ion binding / calcium ion binding / ATP hydrolysis activity ...nitrous-oxide reductase / nitrous-oxide reductase activity / copper ion import / denitrification pathway / cytochrome-c oxidase activity / ABC-type transporter activity / periplasmic space / copper ion binding / calcium ion binding / ATP hydrolysis activity / ATP binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Pseudomonas stutzeri (バクテリア) Pseudomonas stutzeri (バクテリア) | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.78 Å | ||||||||||||
 データ登録者 データ登録者 | Zipfel, S. / Mueller, C. / Topitsch, A. / Lutz, M. / Zhang, L. / Einsle, O. | ||||||||||||
| 資金援助 |  ドイツ, 3件 ドイツ, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Molecular interplay of an assembly machinery for nitrous oxide reductase. 著者: Christoph Müller / Lin Zhang / Sara Zipfel / Annika Topitsch / Marleen Lutz / Johannes Eckert / Benedikt Prasser / Mohamed Chami / Wei Lü / Juan Du / Oliver Einsle /    要旨: Emissions of the critical ozone-depleting and greenhouse gas nitrous oxide (NO) from soils and industrial processes have increased considerably over the last decades. As the final step of bacterial ...Emissions of the critical ozone-depleting and greenhouse gas nitrous oxide (NO) from soils and industrial processes have increased considerably over the last decades. As the final step of bacterial denitrification, NO is reduced to chemically inert N (refs. ) in a reaction that is catalysed by the copper-dependent nitrous oxide reductase (NOR) (ref. ). The assembly of its unique [4Cu:2S] active site cluster Cu requires both the ATP-binding-cassette (ABC) complex NosDFY and the membrane-anchored copper chaperone NosL (refs. ). Here we report cryo-electron microscopy structures of Pseudomonas stutzeri NosDFY and its complexes with NosL and NOR, respectively. We find that the periplasmic NosD protein contains a binding site for a Cu ion and interacts specifically with NosL in its nucleotide-free state, whereas its binding to NOR requires a conformational change that is triggered by ATP binding. Mutually exclusive structures of NosDFY in complex with NosL and with NOR reveal a sequential metal-trafficking and assembly pathway for a highly complex copper site. Within this pathway, NosDFY acts as a mechanical energy transducer rather than as a transporter. It links ATP hydrolysis in the cytoplasm to a conformational transition of the NosD subunit in the periplasm, which is required for NosDFY to switch its interaction partner so that copper ions are handed over from the chaperone NosL to the enzyme NOR. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7qba.cif.gz 7qba.cif.gz | 543.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7qba.ent.gz pdb7qba.ent.gz | 423.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7qba.json.gz 7qba.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7qba_validation.pdf.gz 7qba_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7qba_full_validation.pdf.gz 7qba_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  7qba_validation.xml.gz 7qba_validation.xml.gz | 78.3 KB | 表示 | |
| CIF形式データ |  7qba_validation.cif.gz 7qba_validation.cif.gz | 117.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qb/7qba https://data.pdbj.org/pub/pdb/validation_reports/qb/7qba ftp://data.pdbj.org/pub/pdb/validation_reports/qb/7qba ftp://data.pdbj.org/pub/pdb/validation_reports/qb/7qba | HTTPS FTP |
-関連構造データ
| 関連構造データ |  13885MC  7o0yC  7o0zC  7o10C  7o11C  7o12C  7o13C  7o14C  7o15C  7o16C  7o17C  7osfC  7osgC  7oshC  7osiC  7osjC  7znqC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Probable ABC transporter ... , 3種, 5分子 ABCDE
| #1: タンパク質 | 分子量: 48258.500 Da / 分子数: 1 / 由来タイプ: 組換発現 由来: (組換発現)  Pseudomonas stutzeri (バクテリア) Pseudomonas stutzeri (バクテリア)遺伝子: nosD / 発現宿主:  | ||
|---|---|---|---|
| #2: タンパク質 | 分子量: 34518.402 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  Pseudomonas stutzeri (バクテリア) Pseudomonas stutzeri (バクテリア)遺伝子: nosF / 発現宿主:  #3: タンパク質 | 分子量: 29449.203 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  Pseudomonas stutzeri (バクテリア) Pseudomonas stutzeri (バクテリア)遺伝子: nosY / 発現宿主:  |
-タンパク質 , 1種, 2分子 HI
| #4: タンパク質 | 分子量: 71958.555 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  Pseudomonas stutzeri (バクテリア) Pseudomonas stutzeri (バクテリア)遺伝子: nosZ / 発現宿主:  |
|---|
-非ポリマー , 3種, 6分子 




| #5: 化合物 | | #6: 化合物 | #7: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Heteroheptamer complex of NosZDFY / タイプ: COMPLEX / 詳細: homodimers of NosZ, NosY and NosF; monomer of NosD / Entity ID: #1-#4 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  Pseudomonas stutzeri ATCC 14405 = CCUG 16156 (バクテリア) Pseudomonas stutzeri ATCC 14405 = CCUG 16156 (バクテリア) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 8 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: TFS GLACIOS |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: OTHER |
| 電子レンズ | モード: OTHER |
| 撮影 | 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.2_4158: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.78 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 114710 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj








