+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7nvn | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Human TRiC complex in closed state with nanobody and tubulin bound | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | CHAPERONE / TRiC / CCT / ATP hydrolysis / type II chaperonin / protein folding / tubulin | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Post-chaperonin tubulin folding pathway / positive regulation of establishment of protein localization to telomere / zona pellucida receptor complex / Cilium Assembly / positive regulation of protein localization to Cajal body / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane / Carboxyterminal post-translational modifications of tubulin / scaRNA localization to Cajal body / positive regulation of telomerase RNA localization to Cajal body / tubulin complex assembly ...Post-chaperonin tubulin folding pathway / positive regulation of establishment of protein localization to telomere / zona pellucida receptor complex / Cilium Assembly / positive regulation of protein localization to Cajal body / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane / Carboxyterminal post-translational modifications of tubulin / scaRNA localization to Cajal body / positive regulation of telomerase RNA localization to Cajal body / tubulin complex assembly / chaperonin-containing T-complex / : / BBSome-mediated cargo-targeting to cilium / Intraflagellar transport / Sealing of the nuclear envelope (NE) by ESCRT-III / Formation of tubulin folding intermediates by CCT/TriC / Folding of actin by CCT/TriC / binding of sperm to zona pellucida / Gap junction assembly / Prefoldin mediated transfer of substrate to CCT/TriC / Kinesins / COPI-independent Golgi-to-ER retrograde traffic / Assembly and cell surface presentation of NMDA receptors / RHOBTB1 GTPase cycle / WD40-repeat domain binding / COPI-dependent Golgi-to-ER retrograde traffic / pericentriolar material / beta-tubulin binding / Association of TriC/CCT with target proteins during biosynthesis / Recycling pathway of L1 / RHO GTPases activate IQGAPs / chaperone-mediated protein complex assembly / heterochromatin / RHOBTB2 GTPase cycle / intercellular bridge / Hedgehog 'off' state / Activation of AMPK downstream of NMDARs / COPI-mediated anterograde transport / : / positive regulation of telomere maintenance via telomerase / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / protein folding chaperone / MHC class II antigen presentation / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / Recruitment of NuMA to mitotic centrosomes / Resolution of Sister Chromatid Cohesion / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / acrosomal vesicle / mRNA 3'-UTR binding / cell projection / Translocation of SLC2A4 (GLUT4) to the plasma membrane / ATP-dependent protein folding chaperone / RHO GTPases Activate Formins / PKR-mediated signaling / response to virus / cerebral cortex development / structural constituent of cytoskeleton / microtubule cytoskeleton organization / mRNA 5'-UTR binding / HCMV Early Events / neuron migration / Aggrephagy / mitotic spindle / Separation of Sister Chromatids / The role of GTSE1 in G2/M progression after G2 checkpoint / azurophil granule lumen / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / unfolded protein binding / melanosome / G-protein beta-subunit binding / protein folding / extracellular vesicle / mitotic cell cycle / microtubule cytoskeleton / cell body / secretory granule lumen / microtubule / ficolin-1-rich granule lumen / cytoskeleton / protein stabilization / cilium / cadherin binding / GTPase activity / centrosome / ubiquitin protein ligase binding / Neutrophil degranulation / GTP binding / Golgi apparatus / ATP hydrolysis activity / RNA binding / extracellular exosome / extracellular region / nucleoplasm / ATP binding / metal ion binding / identical protein binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3 Å | ||||||
 データ登録者 データ登録者 | Kelly, J.J. / Chi, G. / Bulawa, C. / Paavilainen, V.O. / Bountra, C. / Huiskonen, J.T. / Yue, W. | ||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2022 ジャーナル: Nat Struct Mol Biol / 年: 2022タイトル: Snapshots of actin and tubulin folding inside the TRiC chaperonin. 著者: John J Kelly / Dale Tranter / Els Pardon / Gamma Chi / Holger Kramer / Lotta Happonen / Kelly M Knee / Jay M Janz / Jan Steyaert / Christine Bulawa / Ville O Paavilainen / Juha T Huiskonen / Wyatt W Yue /      要旨: The integrity of a cell's proteome depends on correct folding of polypeptides by chaperonins. The chaperonin TCP-1 ring complex (TRiC) acts as obligate folder for >10% of cytosolic proteins, ...The integrity of a cell's proteome depends on correct folding of polypeptides by chaperonins. The chaperonin TCP-1 ring complex (TRiC) acts as obligate folder for >10% of cytosolic proteins, including he cytoskeletal proteins actin and tubulin. Although its architecture and how it recognizes folding substrates are emerging from structural studies, the subsequent fate of substrates inside the TRiC chamber is not defined. We trapped endogenous human TRiC with substrates (actin, tubulin) and cochaperone (PhLP2A) at different folding stages, for structure determination by cryo-EM. The already-folded regions of client proteins are anchored at the chamber wall, positioning unstructured regions toward the central space to achieve their native fold. Substrates engage with different sections of the chamber during the folding cycle, coupled to TRiC open-and-close transitions. Further, the cochaperone PhLP2A modulates folding, acting as a molecular strut between substrate and TRiC chamber. Our structural snapshots piece together an emerging model of client protein folding within TRiC. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7nvn.cif.gz 7nvn.cif.gz | 1.5 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7nvn.ent.gz pdb7nvn.ent.gz | 1.2 MB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7nvn.json.gz 7nvn.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7nvn_validation.pdf.gz 7nvn_validation.pdf.gz | 2.4 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7nvn_full_validation.pdf.gz 7nvn_full_validation.pdf.gz | 2.5 MB | 表示 | |
| XML形式データ |  7nvn_validation.xml.gz 7nvn_validation.xml.gz | 213.8 KB | 表示 | |
| CIF形式データ |  7nvn_validation.cif.gz 7nvn_validation.cif.gz | 329.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/nv/7nvn https://data.pdbj.org/pub/pdb/validation_reports/nv/7nvn ftp://data.pdbj.org/pub/pdb/validation_reports/nv/7nvn ftp://data.pdbj.org/pub/pdb/validation_reports/nv/7nvn | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-T-complex protein 1 subunit ... , 8種, 16分子 AaBbDdEeGgHhQqZz
| #1: タンパク質 | 分子量: 60418.477 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P17987 Homo sapiens (ヒト) / 参照: UniProt: P17987#2: タンパク質 | 分子量: 57567.141 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P78371 Homo sapiens (ヒト) / 参照: UniProt: P78371#3: タンパク質 | 分子量: 57996.113 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P50991 Homo sapiens (ヒト) / 参照: UniProt: P50991#4: タンパク質 | 分子量: 59749.957 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CCT5, CCTE, KIAA0098 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CCT5, CCTE, KIAA0098 / 発現宿主:  Homo sapiens (ヒト) / 参照: UniProt: P48643 Homo sapiens (ヒト) / 参照: UniProt: P48643#5: タンパク質 | 分子量: 60613.855 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P49368 Homo sapiens (ヒト) / 参照: UniProt: P49368#6: タンパク質 | 分子量: 59443.535 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q99832 Homo sapiens (ヒト) / 参照: UniProt: Q99832#8: タンパク質 | 分子量: 59691.422 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P50990 Homo sapiens (ヒト) / 参照: UniProt: P50990#9: タンパク質 | 分子量: 58106.086 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: P40227 Homo sapiens (ヒト) / 参照: UniProt: P40227 |
|---|
-抗体 / タンパク質 , 2種, 3分子 NnT
| #10: タンパク質 | 分子量: 49921.730 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / 参照: UniProt: Q13885 Homo sapiens (ヒト) / 参照: UniProt: Q13885 |
|---|---|
| #7: 抗体 | 分子量: 14412.816 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   |
-非ポリマー , 4種, 67分子 

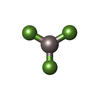




| #11: 化合物 | ChemComp-ADP / #12: 化合物 | ChemComp-MG / #13: 化合物 | ChemComp-AF3 / #14: 水 | ChemComp-HOH / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 |
| ||||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||||
| 由来(組換発現) |
| ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||||||||||||||||||||
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD |
| 撮影 | 電子線照射量: 43 e/Å2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 93758 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 精密化 | 交差検証法: NONE 立体化学のターゲット値: GeoStd + Monomer Library + CDL v1.2 | ||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 73.26 Å2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj










































