+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6u9h | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
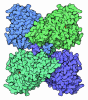
| タイトル | Arabidopsis thaliana acetohydroxyacid synthase complex | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | PLANT PROTEIN / Complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報acetolactate synthase regulator activity / acetolactate synthase / acetolactate synthase activity / regulation of catalytic activity / L-valine biosynthetic process / isoleucine biosynthetic process / thiamine pyrophosphate binding / response to herbicide / chloroplast stroma / chloroplast ...acetolactate synthase regulator activity / acetolactate synthase / acetolactate synthase activity / regulation of catalytic activity / L-valine biosynthetic process / isoleucine biosynthetic process / thiamine pyrophosphate binding / response to herbicide / chloroplast stroma / chloroplast / peroxisome / flavin adenine dinucleotide binding / response to hypoxia / magnesium ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||
 データ登録者 データ登録者 | Guddat, L.W. / Low, Y.S. / Rao, Z. | |||||||||
| 資金援助 |  オーストラリア, 2件 オーストラリア, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2020 ジャーナル: Nature / 年: 2020タイトル: Structures of fungal and plant acetohydroxyacid synthases. 著者: Thierry Lonhienne / Yu Shang Low / Mario D Garcia / Tristan Croll / Yan Gao / Quan Wang / Lou Brillault / Craig M Williams / James A Fraser / Ross P McGeary / Nicholas P West / Michael J ...著者: Thierry Lonhienne / Yu Shang Low / Mario D Garcia / Tristan Croll / Yan Gao / Quan Wang / Lou Brillault / Craig M Williams / James A Fraser / Ross P McGeary / Nicholas P West / Michael J Landsberg / Zihe Rao / Gerhard Schenk / Luke W Guddat /    要旨: Acetohydroxyacid synthase (AHAS), also known as acetolactate synthase, is a flavin adenine dinucleotide-, thiamine diphosphate- and magnesium-dependent enzyme that catalyses the first step in the ...Acetohydroxyacid synthase (AHAS), also known as acetolactate synthase, is a flavin adenine dinucleotide-, thiamine diphosphate- and magnesium-dependent enzyme that catalyses the first step in the biosynthesis of branched-chain amino acids. It is the target for more than 50 commercial herbicides. AHAS requires both catalytic and regulatory subunits for maximal activity and functionality. Here we describe structures of the hexadecameric AHAS complexes of Saccharomyces cerevisiae and dodecameric AHAS complexes of Arabidopsis thaliana. We found that the regulatory subunits of these AHAS complexes form a core to which the catalytic subunit dimers are attached, adopting the shape of a Maltese cross. The structures show how the catalytic and regulatory subunits communicate with each other to provide a pathway for activation and for feedback inhibition by branched-chain amino acids. We also show that the AHAS complex of Mycobacterium tuberculosis adopts a similar structure, thus demonstrating that the overall AHAS architecture is conserved across kingdoms. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6u9h.cif.gz 6u9h.cif.gz | 1 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6u9h.ent.gz pdb6u9h.ent.gz | 849.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6u9h.json.gz 6u9h.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6u9h_validation.pdf.gz 6u9h_validation.pdf.gz | 1.7 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6u9h_full_validation.pdf.gz 6u9h_full_validation.pdf.gz | 1.9 MB | 表示 | |
| XML形式データ |  6u9h_validation.xml.gz 6u9h_validation.xml.gz | 174.9 KB | 表示 | |
| CIF形式データ |  6u9h_validation.cif.gz 6u9h_validation.cif.gz | 253.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/u9/6u9h https://data.pdbj.org/pub/pdb/validation_reports/u9/6u9h ftp://data.pdbj.org/pub/pdb/validation_reports/u9/6u9h ftp://data.pdbj.org/pub/pdb/validation_reports/u9/6u9h | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 64025.203 Da / 分子数: 8 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: ALS, AHAS, CSR1, TZP5, At3g48560, T8P19.70 / 発現宿主:  #2: タンパク質 | 分子量: 53948.906 Da / 分子数: 8 / 由来タイプ: 組換発現 由来: (組換発現)  遺伝子: At2g31810, F20M17.15 / 発現宿主:  #3: 化合物 | ChemComp-MG / #4: 化合物 | ChemComp-FAD / #5: 化合物 | ChemComp-TPP / 研究の焦点であるリガンドがあるか | N | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Acetohydroxyacid synthase quaternary complex / タイプ: COMPLEX / 詳細: Recombinant expression from E. coli. / Entity ID: #1-#2 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.72 MDa / 実験値: NO |
| 由来(天然) | 生物種:  |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.5 |
| 試料 | 濃度: 0.2 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES / 詳細: Glutaraldehyde cross linked |
| 試料支持 | グリッドの材料: COPPER |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 3.2 sec. / 電子線照射量: 60 e/Å2 / 検出モード: SUPER-RESOLUTION フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 撮影したグリッド数: 2 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EMソフトウェア |
| ||||||||||||||||||||||||
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 76 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||
| 原子モデル構築 |
| ||||||||||||||||||||||||
| 精密化 | 立体化学のターゲット値: CDL v1.2 | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj