+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6obj | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
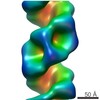
| タイトル | Structure of a DNA-bound dimer extracted from filamentous SgrAI endonuclease in its activated form | |||||||||
 要素 要素 |
| |||||||||
 キーワード キーワード | HYDROLASE/DNA / restriction endonuclease / DNAse / allostery / bacterial innate immunity / filament / hyper-activation / substrate specificity / HYDROLASE-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Streptomyces griseus (ストレプトマイシン生産菌) Streptomyces griseus (ストレプトマイシン生産菌) | |||||||||
| 手法 | 電子顕微鏡法 / らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Polley, S. / Lyumkis, D. / Horton, N.C. | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2019 ジャーナル: Structure / 年: 2019タイトル: Mechanism of Filamentation-Induced Allosteric Activation of the SgrAI Endonuclease. 著者: Smarajit Polley / Dmitry Lyumkis / Nancy C Horton /   要旨: Filament formation by enzymes is increasingly recognized as an important phenomenon with potentially unique regulatory properties and biological roles. SgrAI is an allosterically regulated type II ...Filament formation by enzymes is increasingly recognized as an important phenomenon with potentially unique regulatory properties and biological roles. SgrAI is an allosterically regulated type II restriction endonuclease that forms filaments with enhanced DNA cleavage activity and altered sequence specificity. Here, we present the cryoelectron microscopy (cryo-EM) structure of the filament of SgrAI in its activated configuration. The structural data illuminate the mechanistic origin of hyperaccelerated DNA cleavage activity and suggests how indirect DNA sequence readout within filamentous SgrAI may enable recognition of substantially more nucleotide sequences than its low-activity form, thereby altering and partially relaxing its DNA sequence specificity. Together, substrate DNA binding, indirect readout, and filamentation simultaneously enhance SgrAI's catalytic activity and modulate substrate preference. This unusual enzyme mechanism may have evolved to perform the specialized functions of bacterial innate immunity in rapid defense against invading phage DNA without causing damage to the host DNA. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6obj.cif.gz 6obj.cif.gz | 154.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6obj.ent.gz pdb6obj.ent.gz | 118.1 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6obj.json.gz 6obj.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ob/6obj https://data.pdbj.org/pub/pdb/validation_reports/ob/6obj ftp://data.pdbj.org/pub/pdb/validation_reports/ob/6obj ftp://data.pdbj.org/pub/pdb/validation_reports/ob/6obj | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | x 10
|
| 2 |
|
| 対称性 | らせん対称: (回転対称性: 1 / Dyad axis: no / N subunits divisor: 1 / Num. of operations: 10 / Rise per n subunits: 21.6 Å / Rotation per n subunits: -86.2 °) |
- 要素
要素
| #1: タンパク質 | 分子量: 38073.102 Da / 分子数: 2 / 由来タイプ: 組換発現 由来: (組換発現)  Streptomyces griseus (ストレプトマイシン生産菌) Streptomyces griseus (ストレプトマイシン生産菌)遺伝子: sgraIR / 発現宿主:  参照: UniProt: Q9F6L0, 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ #2: DNA鎖 | 分子量: 12314.889 Da / 分子数: 2 / 由来タイプ: 合成 / 詳細: assembled from pre-cleaved DNAs 由来: (合成)  Streptomyces griseus (ストレプトマイシン生産菌) Streptomyces griseus (ストレプトマイシン生産菌)#3: 化合物 | |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法: らせん対称体再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Filamentous assembly of SgrAI protein bound to pre-cleaved DNA タイプ: COMPLEX / Entity ID: #1-#2 / 由来: RECOMBINANT | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 74 kDa/nm / 実験値: NO | |||||||||||||||||||||||||
| 由来(天然) | 生物種:  Streptomyces griseus (ストレプトマイシン生産菌) Streptomyces griseus (ストレプトマイシン生産菌) | |||||||||||||||||||||||||
| 由来(組換発現) | 生物種:  | |||||||||||||||||||||||||
| 緩衝液 | pH: 8 | |||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||
| 試料 | 濃度: 1 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 400 divisions/in. / グリッドのタイプ: UltrAuFoil | |||||||||||||||||||||||||
| 急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE / 湿度: 80 % |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 22500 X / 倍率(補正後): 38167 X / 最大 デフォーカス(公称値): 2600 nm / 最小 デフォーカス(公称値): 600 nm / Cs: 2.7 mm / C2レンズ絞り径: 70 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 55 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 216 |
| 画像スキャン | 横: 3838 / 縦: 3710 / 動画フレーム数/画像: 60 / 利用したフレーム数/画像: 1-60 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| らせん対称 | 回転角度/サブユニット: -86.2 ° / 軸方向距離/サブユニット: 21.6 Å / らせん対称軸の対称性: C1 | ||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 7 / アルゴリズム: FOURIER SPACE / 対称性のタイプ: HELICAL | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL / 空間: REAL / Target criteria: Correlation coefficient |
 ムービー
ムービー コントローラー
コントローラー











 PDBj
PDBj








































