+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8857 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | MicroED structure of the segment, NFGEFS, from the A315E familial variant of the low complexity domain of TDP-43, residues 312-317 | |||||||||
 マップデータ マップデータ | NFGEFS from the A315E familial variant of the low complexity domain of TDP-43, residues 312-317 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Amyloid / LARKS / TDP-43 / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nuclear inner membrane organization / interchromatin granule / perichromatin fibrils / 3'-UTR-mediated mRNA destabilization / 3'-UTR-mediated mRNA stabilization / intracellular membraneless organelle / negative regulation of protein phosphorylation / host-mediated suppression of viral transcription / pre-mRNA intronic binding / RNA splicing ...nuclear inner membrane organization / interchromatin granule / perichromatin fibrils / 3'-UTR-mediated mRNA destabilization / 3'-UTR-mediated mRNA stabilization / intracellular membraneless organelle / negative regulation of protein phosphorylation / host-mediated suppression of viral transcription / pre-mRNA intronic binding / RNA splicing / response to endoplasmic reticulum stress / mRNA 3'-UTR binding / molecular condensate scaffold activity / regulation of circadian rhythm / positive regulation of insulin secretion / regulation of protein stability / positive regulation of protein import into nucleus / mRNA processing / cytoplasmic stress granule / rhythmic process / regulation of gene expression / double-stranded DNA binding / regulation of apoptotic process / amyloid fibril formation / regulation of cell cycle / nuclear speck / RNA polymerase II cis-regulatory region sequence-specific DNA binding / negative regulation of gene expression / lipid binding / chromatin / mitochondrion / DNA binding / RNA binding / nucleoplasm / identical protein binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子線結晶学 / クライオ電子顕微鏡法 / 解像度: 1.0 Å | |||||||||
 データ登録者 データ登録者 | Guenther EL / Sawaya MR | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2018 ジャーナル: Nat Struct Mol Biol / 年: 2018タイトル: Atomic structures of TDP-43 LCD segments and insights into reversible or pathogenic aggregation. 著者: Elizabeth L Guenther / Qin Cao / Hamilton Trinh / Jiahui Lu / Michael R Sawaya / Duilio Cascio / David R Boyer / Jose A Rodriguez / Michael P Hughes / David S Eisenberg /  要旨: The normally soluble TAR DNA-binding protein 43 (TDP-43) is found aggregated both in reversible stress granules and in irreversible pathogenic amyloid. In TDP-43, the low-complexity domain (LCD) is ...The normally soluble TAR DNA-binding protein 43 (TDP-43) is found aggregated both in reversible stress granules and in irreversible pathogenic amyloid. In TDP-43, the low-complexity domain (LCD) is believed to be involved in both types of aggregation. To uncover the structural origins of these two modes of β-sheet-rich aggregation, we have determined ten structures of segments of the LCD of human TDP-43. Six of these segments form steric zippers characteristic of the spines of pathogenic amyloid fibrils; four others form LARKS, the labile amyloid-like interactions characteristic of protein hydrogels and proteins found in membraneless organelles, including stress granules. Supporting a hypothetical pathway from reversible to irreversible amyloid aggregation, we found that familial ALS variants of TDP-43 convert LARKS to irreversible aggregates. Our structures suggest how TDP-43 adopts both reversible and irreversible β-sheet aggregates and the role of mutation in the possible transition of reversible to irreversible pathogenic aggregation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8857.map.gz emd_8857.map.gz | 107.3 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8857-v30.xml emd-8857-v30.xml emd-8857.xml emd-8857.xml | 11.2 KB 11.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_8857.png emd_8857.png | 350.5 KB | ||
| Filedesc metadata |  emd-8857.cif.gz emd-8857.cif.gz | 4.6 KB | ||
| Filedesc structureFactors |  emd_8857_sf.cif.gz emd_8857_sf.cif.gz | 31.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8857 http://ftp.pdbj.org/pub/emdb/structures/EMD-8857 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8857 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8857 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_8857_validation.pdf.gz emd_8857_validation.pdf.gz | 320.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_8857_full_validation.pdf.gz emd_8857_full_validation.pdf.gz | 319.7 KB | 表示 | |
| XML形式データ |  emd_8857_validation.xml.gz emd_8857_validation.xml.gz | 3.9 KB | 表示 | |
| CIF形式データ |  emd_8857_validation.cif.gz emd_8857_validation.cif.gz | 4.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8857 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8857 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8857 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8857 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5wkbMC  7466C  7467C  5whnC  5whpC  5wiaC  5wiqC  5wkdC  6cb9C  6cewC  6cf4C  6cfhC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8857.map.gz / 形式: CCP4 / 大きさ: 116.2 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8857.map.gz / 形式: CCP4 / 大きさ: 116.2 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | NFGEFS from the A315E familial variant of the low complexity domain of TDP-43, residues 312-317 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X: 0.32402 Å / Y: 0.335 Å / Z: 0.30625 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
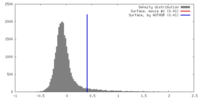
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Segment from TDP-43
| 全体 | 名称: Segment from TDP-43 |
|---|---|
| 要素 |
|
-超分子 #1: Segment from TDP-43
| 超分子 | 名称: Segment from TDP-43 / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: TAR DNA-binding protein 43
| 分子 | 名称: TAR DNA-binding protein 43 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 699.709 Da |
| 配列 | 文字列: NFGEFS UniProtKB: TAR DNA-binding protein 43 |
-分子 #2: water
| 分子 | 名称: water / タイプ: ligand / ID: 2 / コピー数: 2 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 電子線結晶学 |
| 試料の集合状態 | 3D array |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 / 構成要素 - 名称: 1x PBS / 詳細: 1x PBS, pH 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 撮影 | フィルム・検出器のモデル: TVIPS TEMCAM-F416 (4k x 4k) デジタル化 - サイズ - 横: 2048 pixel / デジタル化 - サイズ - 縦: 2048 pixel / 平均電子線量: 3.4 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: DIFFRACTION / カメラ長: 1840 mm |
| 試料ステージ | 試料ホルダーモデル: GATAN 626 SINGLE TILT LIQUID NITROGEN CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 1.0 Å / 解像度の算出法: DIFFRACTION PATTERN/LAYERLINES |
|---|---|
| Molecular replacement | ソフトウェア - 名称: SHELXD |
| Merging software list | ソフトウェア - 名称: XSCALE |
| Crystallography statistics | Number intensities measured: 18942 / Number structure factors: 2032 / Fourier space coverage: 88.7 / R sym: 28.3 / R merge: 28.3 / Overall phase error: 0.001 / Overall phase residual: 0.001 / Phase error rejection criteria: 1 / High resolution: 1.0 Å / 殻 - Shell ID: 1 / 殻 - High resolution: 1.0 Å / 殻 - Low resolution: 1.03 Å / 殻 - Number structure factors: 110 / 殻 - Phase residual: 0.001 / 殻 - Fourier space coverage: 78 / 殻 - Multiplicity: 4.8 |
 ムービー
ムービー コントローラー
コントローラー





 Y (Sec.)
Y (Sec.) X (Row.)
X (Row.) Z (Col.)
Z (Col.)