+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8273 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
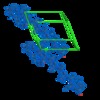
| タイトル | Human Islet Amyloid Polypeptide Segment 15-FLVHSSNNFGA-25 Determined by MicroED | |||||||||
 マップデータ マップデータ | Sigma-A-weighted 2Fo-Fc map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Amyloid / islet amyloid polypeptide / Type II Diabetes / Toxic Spine / MicroED / PROTEIN FIBRIL | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling / Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly ...: / amylin receptor signaling pathway / Calcitonin-like ligand receptors / negative regulation of amyloid fibril formation / negative regulation of bone resorption / eating behavior / negative regulation of osteoclast differentiation / positive regulation of protein kinase A signaling / Regulation of gene expression in beta cells / negative regulation of protein-containing complex assembly / positive regulation of calcium-mediated signaling / bone resorption / sensory perception of pain / osteoclast differentiation / hormone activity / cell-cell signaling / amyloid-beta binding / G alpha (s) signalling events / positive regulation of MAPK cascade / receptor ligand activity / positive regulation of apoptotic process / Amyloid fiber formation / signaling receptor binding / lipid binding / apoptotic process / signal transduction / extracellular space / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 電子線結晶学 / クライオ電子顕微鏡法 / 解像度: 1.4 Å | |||||||||
 データ登録者 データ登録者 | Krotee PAL / Rodriguez JA | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2017 ジャーナル: Elife / 年: 2017タイトル: Atomic structures of fibrillar segments of hIAPP suggest tightly mated β-sheets are important for cytotoxicity. 著者: Pascal Krotee / Jose A Rodriguez / Michael R Sawaya / Duilio Cascio / Francis E Reyes / Dan Shi / Johan Hattne / Brent L Nannenga / Marie E Oskarsson / Stephan Philipp / Sarah Griner / Lin ...著者: Pascal Krotee / Jose A Rodriguez / Michael R Sawaya / Duilio Cascio / Francis E Reyes / Dan Shi / Johan Hattne / Brent L Nannenga / Marie E Oskarsson / Stephan Philipp / Sarah Griner / Lin Jiang / Charles G Glabe / Gunilla T Westermark / Tamir Gonen / David S Eisenberg /    要旨: hIAPP fibrils are associated with Type-II Diabetes, but the link of hIAPP structure to islet cell death remains elusive. Here we observe that hIAPP fibrils are cytotoxic to cultured pancreatic β- ...hIAPP fibrils are associated with Type-II Diabetes, but the link of hIAPP structure to islet cell death remains elusive. Here we observe that hIAPP fibrils are cytotoxic to cultured pancreatic β-cells, leading us to determine the structure and cytotoxicity of protein segments composing the amyloid spine of hIAPP. Using the cryoEM method MicroED, we discover that one segment, 19-29 S20G, forms pairs of β-sheets mated by a dry interface that share structural features with and are similarly cytotoxic to full-length hIAPP fibrils. In contrast, a second segment, 15-25 WT, forms non-toxic labile β-sheets. These segments possess different structures and cytotoxic effects, however, both can seed full-length hIAPP, and cause hIAPP to take on the cytotoxic and structural features of that segment. These results suggest that protein segment structures represent polymorphs of their parent protein and that segment 19-29 S20G may serve as a model for the toxic spine of hIAPP. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8273.map.gz emd_8273.map.gz | 165.9 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8273-v30.xml emd-8273-v30.xml emd-8273.xml emd-8273.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_8273.png emd_8273.png | 116.4 KB | ||
| Filedesc metadata |  emd-8273.cif.gz emd-8273.cif.gz | 5.5 KB | ||
| Filedesc structureFactors |  emd_8273_sf.cif.gz emd_8273_sf.cif.gz | 39.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8273 http://ftp.pdbj.org/pub/emdb/structures/EMD-8273 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8273 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8273 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_8273_validation.pdf.gz emd_8273_validation.pdf.gz | 422.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_8273_full_validation.pdf.gz emd_8273_full_validation.pdf.gz | 421.7 KB | 表示 | |
| XML形式データ |  emd_8273_validation.xml.gz emd_8273_validation.xml.gz | 4.1 KB | 表示 | |
| CIF形式データ |  emd_8273_validation.cif.gz emd_8273_validation.cif.gz | 4.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8273 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8273 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8273 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8273 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5ko0MC  8272C  5knzC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8273.map.gz / 形式: CCP4 / 大きさ: 179.7 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8273.map.gz / 形式: CCP4 / 大きさ: 179.7 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sigma-A-weighted 2Fo-Fc map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X: 0.449 Å / Y: 0.455 Å / Z: 0.453 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Amyloid fiber
| 全体 | 名称: Amyloid fiber |
|---|---|
| 要素 |
|
-超分子 #1: Amyloid fiber
| 超分子 | 名称: Amyloid fiber / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 分子量 | 理論値: 4.075 kDa/nm |
-分子 #1: hIAPP(15-25)WT
| 分子 | 名称: hIAPP(15-25)WT / タイプ: protein_or_peptide / ID: 1 / 詳細: islet amyloid / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 1.193289 KDa |
| 配列 | 文字列: FLVHSSNNFG A UniProtKB: Islet amyloid polypeptide |
-分子 #2: THIOCYANATE ION
| 分子 | 名称: THIOCYANATE ION / タイプ: ligand / ID: 2 / コピー数: 1 / 式: SCN |
|---|---|
| 分子量 | 理論値: 58.082 Da |
| Chemical component information | 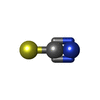 ChemComp-SCN: |
-分子 #3: water
| 分子 | 名称: water / タイプ: ligand / ID: 3 / コピー数: 6 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 電子線結晶学 |
| 試料の集合状態 | 3D array |
- 試料調製
試料調製
| 濃度 | 20 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 支持フィルム - Film thickness: 30 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE | |||||||||
| 結晶化 | 装置: Hanging Drop Vapor Diffusion Tray / 雰囲気: Air, sealed chamber / 温度: 277.0 K / 時間: 7.0 DAY 詳細: 20 mg/mL Lyophilized peptide in ice-cold water. Crystals were grown using the hanging drop vapor diffusion method at 4 degrees C in 0.35 M sodium thiocyanate and 35% MPD. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI 20 |
|---|---|
| 温度 | 最低: 100.0 K / 最高: 100.0 K |
| 撮影 | フィルム・検出器のモデル: TVIPS TEMCAM-F416 (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 2 / 回折像の数: 879 / 平均露光時間: 2.0 sec. / 平均電子線量: 0.01 e/Å2 詳細: The detector was operated in rolling shutter mode with 2x2 pixel binning. |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: DIFFRACTION / カメラ長: 1840 mm |
| 試料ステージ | 試料ホルダーモデル: GATAN 626 SINGLE TILT LIQUID NITROGEN CRYO TRANSFER HOLDER ホルダー冷却材: NITROGEN |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 1.4 Å / 解像度の算出法: DIFFRACTION PATTERN/LAYERLINES |
|---|---|
| 初期モデル | モデルのタイプ: PDB ENTRY / 詳細: 5.0E+61 |
| Molecular replacement | ソフトウェア - 名称: Phaser (ver. 2.5.6) |
| Crystallography statistics | Number intensities measured: 9014 / Number structure factors: 2180 / Fourier space coverage: 75 / R sym: 0.193 / R merge: 0.193 / Overall phase error: 0.01 / Overall phase residual: 0.01 / Phase error rejection criteria: 0 / High resolution: 1.4 Å 詳細: Phasing statistics are not applicable. No imaging was used. The phases were obtained using molecular replacement. 殻 - Shell ID: 1 / 殻 - High resolution: 1.4 Å / 殻 - Low resolution: 22.0 Å / 殻 - Number structure factors: 2180 / 殻 - Phase residual: 0.01 / 殻 - Fourier space coverage: 75 / 殻 - Multiplicity: 4.1 |
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: OTHER / 温度因子: 9.03 / 当てはまり具合の基準: maximum likelihood |
|---|---|
| 得られたモデル |  PDB-5ko0: |
 ムービー
ムービー コントローラー
コントローラー