+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5783 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
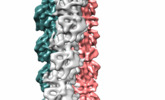
| タイトル | Bacteriophage-encoded Tubulin Homologue PhuZ Forms a Three-Stranded Filament | |||||||||
 マップデータ マップデータ | Reconstruction of PhuZ filament structure | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | PhuZ / FtsZ/tubulin-related protein / filament / helical reconstruction / Pseudomonas bacteriophages / 201phi2-1 | |||||||||
| 機能・相同性 | establishment of localization / Tubulin/FtsZ, GTPase domain / Tubulin/FtsZ, GTPase domain superfamily / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / host cell cytoplasm / GTPase activity / GTP binding / identical protein binding / Phage tubulin-like protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Pseudomonas phage 201phi2-1 (ファージ) Pseudomonas phage 201phi2-1 (ファージ) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 7.1 Å | |||||||||
 データ登録者 データ登録者 | Zehr EA / Kraemer JA / Erb ML / Coker JKC / Montabana EA / Pogliano J / Agard DA | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2014 ジャーナル: Structure / 年: 2014タイトル: The structure and assembly mechanism of a novel three-stranded tubulin filament that centers phage DNA. 著者: Elena A Zehr / James A Kraemer / Marcella L Erb / Joanna K C Coker / Elizabeth A Montabana / Joe Pogliano / David A Agard /  要旨: Tubulins are a universally conserved protein superfamily that carry out diverse biological roles by assembling filaments with very different architectures. The underlying basis of this structural ...Tubulins are a universally conserved protein superfamily that carry out diverse biological roles by assembling filaments with very different architectures. The underlying basis of this structural diversity is poorly understood. Here, we determine a 7.1 Å cryo-electron microscopy reconstruction of the bacteriophage-encoded PhuZ filament and provide molecular-level insight into its cooperative assembly mechanism. The PhuZ family of tubulins is required to actively center the phage within infected host cells, facilitating efficient phage replication. Our reconstruction and derived model reveal the first example of a three-stranded tubulin filament. We show that the elongated C-terminal tail simultaneously stabilizes both longitudinal and lateral interactions, which in turn define filament architecture. Identified interaction surfaces are conserved within the PhuZ family, and their mutagenesis compromises polymerization in vitro and in vivo. Combining kinetic modeling of PhuZ filament assembly and structural data, we suggest a common filament structure and assembly mechanism for the PhuZ family of tubulins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5783.map.gz emd_5783.map.gz | 28.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5783-v30.xml emd-5783-v30.xml emd-5783.xml emd-5783.xml | 10.7 KB 10.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  400_5783.gif 400_5783.gif 80_5783.gif 80_5783.gif | 75.5 KB 5.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5783 http://ftp.pdbj.org/pub/emdb/structures/EMD-5783 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5783 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5783 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5783_validation.pdf.gz emd_5783_validation.pdf.gz | 344 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5783_full_validation.pdf.gz emd_5783_full_validation.pdf.gz | 343.5 KB | 表示 | |
| XML形式データ |  emd_5783_validation.xml.gz emd_5783_validation.xml.gz | 5.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5783 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5783 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5783 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5783 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5783.map.gz / 形式: CCP4 / 大きさ: 29.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5783.map.gz / 形式: CCP4 / 大きさ: 29.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of PhuZ filament structure | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.20398 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : PhuZ201 filament
| 全体 | 名称: PhuZ201 filament |
|---|---|
| 要素 |
|
-超分子 #1000: PhuZ201 filament
| 超分子 | 名称: PhuZ201 filament / タイプ: sample / ID: 1000 / 集合状態: filament / Number unique components: 1 |
|---|
-分子 #1: PhuZ
| 分子 | 名称: PhuZ / タイプ: protein_or_peptide / ID: 1 / Name.synonym: PhuZ201 / 集合状態: polymer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Pseudomonas phage 201phi2-1 (ファージ) / 別称: bacteriophage Pseudomonas phage 201phi2-1 (ファージ) / 別称: bacteriophage |
| 分子量 | 実験値: 34.621 KDa / 理論値: 34.621 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Phage tubulin-like protein / InterPro: Tubulin/FtsZ, GTPase domain |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.7 mg/mL |
|---|---|
| 緩衝液 | pH: 8 詳細: 50 mM HEPES, 125 mM KCl, 5 mM MgCl2, 5% glycerol, 1 mM GMPCPP |
| グリッド | 詳細: C-FLAT holey carbon grid, 200 mesh copper grid |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / 装置: FEI VITROBOT MARK III 手法: Sample was applied to C-FLAT holey carbon grids, blotted for 2 seconds, and flash frozen in liquid ethane |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| アライメント法 | Legacy - 非点収差: Astigmatism corrected at 250,000 times magnification |
| 日付 | 2011年11月21日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F816 (8k x 8k) 実像数: 461 / 平均電子線量: 25 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.2 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.7 µm / 倍率(公称値): 62000 |
| 試料ステージ | 試料ホルダーモデル: OTHER |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | Reconstruction was determined by IHRSR. |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 14.4 Å 想定した対称性 - らせんパラメータ - ΔΦ: 116.4 ° アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 7.1 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: Spider |
| CTF補正 | 詳細: Whole micrograph |
 ムービー
ムービー コントローラー
コントローラー