+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4917 | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the dynein-2 complex; motor domains | |||||||||||||||||||||||||||
 マップデータ マップデータ | Motor domain map, sharpened and masked | |||||||||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||||||||
 キーワード キーワード | dynein / cilia / intraflagellar transport / complex / motor protein | |||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報organelle organization / methylated-DNA-[protein]-cysteine S-methyltransferase / methylated-DNA-[protein]-cysteine S-methyltransferase activity / DNA modification / dynein complex / cell projection organization / minus-end-directed microtubule motor activity / dynein light intermediate chain binding / dynein intermediate chain binding / microtubule-based movement ...organelle organization / methylated-DNA-[protein]-cysteine S-methyltransferase / methylated-DNA-[protein]-cysteine S-methyltransferase activity / DNA modification / dynein complex / cell projection organization / minus-end-directed microtubule motor activity / dynein light intermediate chain binding / dynein intermediate chain binding / microtubule-based movement / cilium / methylation / microtubule / DNA repair / ATP hydrolysis activity / DNA binding / ATP binding / nucleus / metal ion binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||
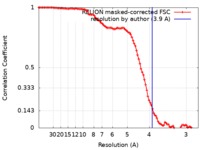
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.9 Å | |||||||||||||||||||||||||||
 データ登録者 データ登録者 | Toropova K / Zalyte R | |||||||||||||||||||||||||||
| 資金援助 |  英国, 8件 英国, 8件
| |||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2019 ジャーナル: Nat Struct Mol Biol / 年: 2019タイトル: Structure of the dynein-2 complex and its assembly with intraflagellar transport trains. 著者: Katerina Toropova / Ruta Zalyte / Aakash G Mukhopadhyay / Miroslav Mladenov / Andrew P Carter / Anthony J Roberts /  要旨: Dynein-2 assembles with polymeric intraflagellar transport (IFT) trains to form a transport machinery that is crucial for cilia biogenesis and signaling. Here we recombinantly expressed the ~1.4-MDa ...Dynein-2 assembles with polymeric intraflagellar transport (IFT) trains to form a transport machinery that is crucial for cilia biogenesis and signaling. Here we recombinantly expressed the ~1.4-MDa human dynein-2 complex and solved its cryo-EM structure to near-atomic resolution. The two identical copies of the dynein-2 heavy chain are contorted into different conformations by a WDR60-WDR34 heterodimer and a block of two RB and six LC8 light chains. One heavy chain is steered into a zig-zag conformation, which matches the periodicity of the anterograde IFT-B train. Contacts between adjacent dyneins along the train indicate a cooperative mode of assembly. Removal of the WDR60-WDR34-light chain subcomplex renders dynein-2 monomeric and relieves autoinhibition of its motility. Our results converge on a model in which an unusual stoichiometry of non-motor subunits controls dynein-2 assembly, asymmetry, and activity, giving mechanistic insight into the interaction of dynein-2 with IFT trains and the origin of diverse functions in the dynein family. | |||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4917.map.gz emd_4917.map.gz | 6.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4917-v30.xml emd-4917-v30.xml emd-4917.xml emd-4917.xml | 25.1 KB 25.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4917_fsc.xml emd_4917_fsc.xml | 10 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4917.png emd_4917.png | 137.6 KB | ||
| マスクデータ |  emd_4917_msk_1.map emd_4917_msk_1.map | 83.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-4917.cif.gz emd-4917.cif.gz | 9 KB | ||
| その他 |  emd_4917_additional.map.gz emd_4917_additional.map.gz emd_4917_half_map_1.map.gz emd_4917_half_map_1.map.gz emd_4917_half_map_2.map.gz emd_4917_half_map_2.map.gz | 64 MB 64.2 MB 64.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4917 http://ftp.pdbj.org/pub/emdb/structures/EMD-4917 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4917 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4917 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4917_validation.pdf.gz emd_4917_validation.pdf.gz | 745.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4917_full_validation.pdf.gz emd_4917_full_validation.pdf.gz | 745.2 KB | 表示 | |
| XML形式データ |  emd_4917_validation.xml.gz emd_4917_validation.xml.gz | 17.1 KB | 表示 | |
| CIF形式データ |  emd_4917_validation.cif.gz emd_4917_validation.cif.gz | 22.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4917 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4917 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4917 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4917 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4917.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4917.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Motor domain map, sharpened and masked | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.39 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_4917_msk_1.map emd_4917_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
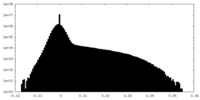
| 密度ヒストグラム |
-追加マップ: Motor domain map, unsharpened and unmasked
| ファイル | emd_4917_additional.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Motor domain map, unsharpened and unmasked | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
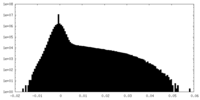
| 密度ヒストグラム |
-ハーフマップ: Motor domain half map 2, unmasked
| ファイル | emd_4917_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Motor domain half map 2, unmasked | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Motor domain half map 1, unmasked
| ファイル | emd_4917_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Motor domain half map 1, unmasked | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Dynein-2 complex; motor domains
| 全体 | 名称: Dynein-2 complex; motor domains |
|---|---|
| 要素 |
|
-超分子 #1: Dynein-2 complex; motor domains
| 超分子 | 名称: Dynein-2 complex; motor domains / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: O6-alkylguanine-DNA alkyltransferase mutant,DYNC2H1 variant protein
| 分子 | 名称: O6-alkylguanine-DNA alkyltransferase mutant,DYNC2H1 variant protein タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 515.223031 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GDKDCEMKRT TLDSPLGKLE LSGCEQGLHR IIFLGKGTSA ADAVEVPAPA AVLGGPEPLM QATAWLNAYF HQPEAIEEFP VPALHHPVF QQESFTRQVL WKLLKVVKFG EVISYSHLAA LAGNPAATAA VKTALSGNPV PILIPCHRVV QGDLDVGGYE G GLAVKEWL ...文字列: GDKDCEMKRT TLDSPLGKLE LSGCEQGLHR IIFLGKGTSA ADAVEVPAPA AVLGGPEPLM QATAWLNAYF HQPEAIEEFP VPALHHPVF QQESFTRQVL WKLLKVVKFG EVISYSHLAA LAGNPAATAA VKTALSGNPV PILIPCHRVV QGDLDVGGYE G GLAVKEWL LAHEGHRLGK PGLGGSLEVL FQGPDYDIPT TLEVLFQGPA NGTADVRKLF IFTTTQNYFG LMSELWDQPL LC NCLEINN FLDDGNQMLL RVQRSDAGIS FSNTIEFGDT KDKVLVFFKL RPEVITDENL HDNILVSSML ESPISSLYQA VRQ VFAPML LKDQEWSRNF DPKLQNLLSE LEAGLGIVLR RSDTNLTKLK FKEDDTRGIL TPSDEFQFWI EQAHRGNKQI SKER ANYFK ELFETIAREF YNLDSLSLLE VVDLVETTQD VVDDVWRQTE HDHYPESRML HLLDIIGGSF GRFVQKKLGT LNLWE DPYY LVKESLKAGI SICEQWVIVC NHLTGQVWQR YVPHPWKNEK YFPETLDKLG KRLEEVLAIR TIHEKFLYFL PASEEK IIC LTRVFEPFTG LNPVQYNPYT EPLWKAAVSQ YEKIIAPAEQ KIAGKLKNYI SEIQDSPQQL LQAFLKYKEL VKRPTIS KE LMLERETLLA RLVDSIKDFR LDFENRCRGI PGDASGPLSG KNLSEVVNSI VWVRQLELKV DDTIKIAEAL LSDLPGFR C FHQSAKDLLD QLKLYEQEQF DDWSRDIQSG LSDSRSGLCI EASSRIMELD SNDGLLKVHY SDRLVILLRE VRQLSALGF VIPAKIQQVA NIAQKFCKQA IILKQVAHFY NSIDQQMIQS QRPMMLQSAL AFEQIIKNSK AGSGGKSQIT WDNPKELEGY IQKLQNAAE RLATENRKLR KWHTTFCEKV VVLMNIDLLR QQQRWKDGLQ ELRTGLATVE AQGFQASDMH AWKQHWNHQL Y KALEHQYQ MGLEALNENL PEINIDLTYK QGRLQFRPPF EEIRAKYYRE MKRFIGIPNQ FKGVGEAGDE SIFSIMIDRN AS GFLTIFS KAEDLFRRLS AVLHQHKEWI VIGQVDMEAL VEKHLFTVHD WEKNFKALKI KGKEVERLPS AVKVDCLNIN CNP VKTVID DLIQKLFDLL VLSLKKSIQA HLHEIDTFVT EAMEVLTIMP QSVEEIGDAN LQYSKLQERK PEILPLFQEA EDKN RLLRT VAGGGLETIS NLKAKWDKFE LMMESHQLMI KDQIEVMKGN VKSRLQIYYQ ELEKFKARWD QLKPGDDVIE TGQHN TLDK SAKLIKEKKI EFDDLEVTRK KLVDDCHHFR LEEPNFSLAS SISKDIESCA QIWAFYEEFQ QGFQEMANED WITFRT KTY LFEEFLMNWH DRLRKVEEHS VMTVKLQSEV DKYKIVIPIL KYVRGEHLSP DHWLDLFRLL GLPRGTSLEK LLFGDLL RV ADTIVAKAAD LKDLNSRAQG EVTIREALRE LDLWGVGAVF TLIDYEDSQS RTMKLIKDWK DIVNQVGDNR CLLQSLKD S PYYKGFEDKV SIWERKLAEL DEYLQNLNHI QRKWVYLEPI FGRGALPKEQ TRFNRVDEDF RSIMTDIKKD NRVTTLTTH AGIRNSLLTI LDQLQRCQRS LNEFLEEKRS AFPRFYFIGD DDLLEILGQS TNPSVIQSHL KKLFAGINSV CFDEKSKHIT AMKSLEGEV VPFKNKVPLS NNVETWLNDL ALEMKKTLEQ LLKECVTTGR SSQGAVDPSL FPSQILCLAE QIKFTEDVEN A IKDHSLHQ IETQLVNKLE QYTNIDTSSE DPGNTESGIL ELKLKALILD IIHNIDVVKQ LNQIQVHTTE DWAWKKQLRF YM KSDHTCC VQMVDSEFQY TYEYQGNASK LVYTPLTDKC YLTLTQAMKM GLGGNPYGPA GTGKTESVKA LGGLLGRQVL VFN CDEGID VKSMGRIFVG LVKCGAWGCF DEFNRLEESV LSAVSMQIQT IQDALKNHRT VCELLGKEVE VNSNSGIFIT MNPA GKGYG GRQKLPDNLK QLFRPVAMSH PDNELIAEVI LYSEGFKDAK VLSRKLVAIF NLSRELLTPQ QHYDWGLRAL KTVLR GSGN LLRQLNKSGT TQNANESHIV VQALRLNTMS KFTFTDCTRF DALIKDVFPG IELKEVEYDE LSAALKQVFE EANYEI IPN QIKKALELYE QLCQRMGVVI VGPSGAGKST LWRMLRAALC KTGKVVKQYT MNPKAMPRYQ LLGHIDMDTR EWSDGVL TN SARQVVREPQ DVSSWIICDG DIDPEWIESL NSVLDDNRLL TMPSGERIQF GPNVNFVFET HDLSCASPAT ISRMGMIF L SDEETDLNSL IKSWLRNQPA EYRNNLENWI GDYFEKALQW VLKQNDYVVE TSLVGTVMNG LSHLHGCRDH DEFIINLIR GLGGNLNMKS RLEFTKEVFH WARESPPDFH KPMDTYYDST RGRLATYVLK KPEDLTADDF SNGLTLPVIQ TPDMQRGLDY FKPWLSSDT KQPFILVGPE GCGKGMLLRY AFSQLRSTQI ATVHCSAQTT SRHLLQKLSQ TCMVISTNTG RVYRPKDCER L VLYLKDIN LPKLDKWGTS TLVAFLQQVL TYQGFYDENL EWVGLENIQI VASMSAGGRL GRHKLTTRFT SIVRLCSIDY PE REQLQTI YGAYLEPVLH KNLKNHSIWG SSSKIYLLAG SMVQVYEQVR AKFTVDDYSH YFFTPCILTQ WVLGLFRYDL EGG SSNHPL DYVLEIVAYE ARRLFRDKIV GAKELHLFDI ILTSVFQGDW GSDILDNMSD SFYVTWGARH NSGARAAPGQ PLPP HGKPL GKLNSTDLKD VIKKGLIHYG RDNQNLDILL FHEVLEYMSR IDRVLSFPGG SLLLAGRSGV GRRTITSLVS HMHGA VLFS PKISRGYELK QFKNDLKHVL QLAGIEAQQV VLLLEDYQFV HPTFLEMINS LLSSGEVPGL YTLEELEPLL LPLKDQ ASQ DGFFGPVFNY FTYRIQQNLH IVLIMDSANS NFMINCESNP ALHKKCQVLW MEGWSNSSMK KIPEMLFSET GGGEKYN DK KRKEEKKKNS VDPDFLKSFL LIHESCKAYG ATPSQYMTFL HVYSAISSSK KKELLKRQSH LQAGVSKLNE AKALVDEL N RKAGEQSVLL KTKQDEADAA LQMITVSMQD ASEQKTELER LKHRIAEEVV KIEERKNKID DELKEVQPLV NEAKLAVGN IKPESLSEIR SLRMPPDVIR DILEGVLRLM GIFDTSWVSM KSFLAKRGVR EDIATFDARN ISKEIRESVE ELLFKNKGSF DPKNAKRAS TAAAPLAAWV KANIQYSHVL ERIHPLETEQ AGLESNLKKT EDRKRKLEEL LNSVGQKVSE LKEKFQSRTS E AAKLEAEV SKAQETIKAA EVLINQLDRE HKRWNAQVVE ITEELATLPK RAQLAAAFIT YLSAAPESLR KTCLEEWTKS AG LEKFDLR RFLCTESEQL IWKSEGLPSD DLSIENALVI LQSRVCPFLI DPSSQATEWL KTHLKDSRLE VINQQDSNFI TAL ELAVRF GKTLIIQEMD GVEPVLYPLL RRDLVAQGPR YVVQIGDKII DYNEEFRLFL STRNPNPFIP PDAASIVTEV NFTT TRSGL RGQLLALTIQ HEKPDLEEQK TKLLQQEEDK KIQLAKLEES LLETLATSQG NILENKDLIE SLNQTKASSA LIQES LKES YKLQISLDQE RDAYLPLAES ASKMYFIISD LSKINNMYRF SLAAFLRLFQ RALQNKQDSE NTEQRIQSLI SSLQHM VYE YICRCLFKAD QLMFALHFVR GMHPELFQEN EWDTFTGVVV GDMLRKADSQ QKIRDQLPSW IDQERSWAVA TLKIALP SL YQTLCFEDAA LWRTYYNNSM CEQEFPSILA KKVSLFQQIL VVQVLRPDRL QSAMALFACK TLGLKEVSPL PLNLKRLY K ETLEIEPILI IISPGADPSQ ELQELANAER SGECYHQVAM GQGQADLAIQ MLKECARNGD WLCLKNLHLV VSWLPVLEK ELNTLQPKDT FRLWLTAEVH PNFTPILLQS SLKITYESPP GLKKNLMRTY ESWTPEQISK KDNTHRAHAL FSLAWFHAAC QERRNYIPQ GWTKFYEFSL SDLRAGYNII DRLFDGAKDV QWEFVHGLLE NAIYGGRIDN YFDLRVLQSY LKQFFNSSVI D VFNQRNKK SIFPYSVSLP QSCSILDYRA VIEKIPEDDK PSFFGLPANI ARSSQRMISS QVISQLRILG RSITAGSKFD RE IWSNELS PVLNLWKKLN QNSNLIHQKV PPPNDRQGSP ILSFIILEQF NAIRLVQSVH QSLAALSKVI RGTTLLSSEV QKL ASALLN QKCPLAWQSK WEGPEDPLQY LRGLVARALA IQNWVDKAEK QALLSETLDL SELFHPDTFL NALRQETARA VGRS VDSLK FVASWKGRLQ EAKLQIKISG LLLEGCSFDG NQLSENQLDS PSVSSVLPCF MGWIPQDACG PYSPDECISL PVYTS AERD RVVTNIDVPC GGNQDQWIQC GAALFLKNQ UniProtKB: Methylated-DNA--protein-cysteine methyltransferase, Cytoplasmic dynein 2 heavy chain 1 |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 6 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: LACEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 49.6 e/Å2 詳細: Average electron dose per image (e-/A2) for additional datasets was 46.8 and 45.4 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー

















 Z
Z Y
Y X
X