+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human TRPM4 channel subunit in complex with calcium 37 degrees Celsius | ||||||||||||||||||||||||||||||
 マップデータ マップデータ | |||||||||||||||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||||||||||||||
 キーワード キーワード | ion channel / TRP channel / TRANSPORT PROTEIN | ||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of atrial cardiac muscle cell action potential / positive regulation of regulation of vascular associated smooth muscle cell membrane depolarization / sodium channel complex / regulation of T cell cytokine production / membrane depolarization during AV node cell action potential / metal ion transport / membrane depolarization during bundle of His cell action potential / membrane depolarization during Purkinje myocyte cell action potential / negative regulation of bone mineralization / regulation of ventricular cardiac muscle cell action potential ...positive regulation of atrial cardiac muscle cell action potential / positive regulation of regulation of vascular associated smooth muscle cell membrane depolarization / sodium channel complex / regulation of T cell cytokine production / membrane depolarization during AV node cell action potential / metal ion transport / membrane depolarization during bundle of His cell action potential / membrane depolarization during Purkinje myocyte cell action potential / negative regulation of bone mineralization / regulation of ventricular cardiac muscle cell action potential / calcium-activated cation channel activity / sodium ion import across plasma membrane / inorganic cation transmembrane transport / dendritic cell chemotaxis / cellular response to ATP / TRP channels / sodium channel activity / monoatomic cation transmembrane transport / regulation of heart rate by cardiac conduction / protein sumoylation / negative regulation of osteoblast differentiation / positive regulation of fat cell differentiation / positive regulation of insulin secretion involved in cellular response to glucose stimulus / positive regulation of heart rate / positive regulation of vasoconstriction / positive regulation of adipose tissue development / calcium-mediated signaling / calcium ion transmembrane transport / calcium channel activity / Sensory perception of sweet, bitter, and umami (glutamate) taste / positive regulation of canonical Wnt signaling pathway / positive regulation of cytosolic calcium ion concentration / protein homotetramerization / adaptive immune response / calmodulin binding / neuronal cell body / positive regulation of cell population proliferation / calcium ion binding / endoplasmic reticulum / Golgi apparatus / nucleoplasm / ATP binding / identical protein binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | ||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Hu J / Lu W / Du J | ||||||||||||||||||||||||||||||
| 資金援助 |  米国, 9件 米国, 9件
| ||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Physiological temperature drives TRPM4 ligand recognition and gating. 著者: Jinhong Hu / Sung Jin Park / Tyler Walter / Ian J Orozco / Garrett O'Dea / Xinyu Ye / Juan Du / Wei Lü /  要旨: Temperature profoundly affects macromolecular function, particularly in proteins with temperature sensitivity. However, its impact is often overlooked in biophysical studies that are typically ...Temperature profoundly affects macromolecular function, particularly in proteins with temperature sensitivity. However, its impact is often overlooked in biophysical studies that are typically performed at non-physiological temperatures, potentially leading to inaccurate mechanistic and pharmacological insights. Here we demonstrate temperature-dependent changes in the structure and function of TRPM4, a temperature-sensitive Ca-activated ion channel. By studying TRPM4 prepared at physiological temperature using single-particle cryo-electron microscopy, we identified a 'warm' conformation that is distinct from those observed at lower temperatures. This conformation is driven by a temperature-dependent Ca-binding site in the intracellular domain, and is essential for TRPM4 function in physiological contexts. We demonstrated that ligands, exemplified by decavanadate (a positive modulator) and ATP (an inhibitor), bind to different locations of TRPM4 at physiological temperatures than at lower temperatures, and that these sites have bona fide functional relevance. We elucidated the TRPM4 gating mechanism by capturing structural snapshots of its different functional states at physiological temperatures, revealing the channel opening that is not observed at lower temperatures. Our study provides an example of temperature-dependent ligand recognition and modulation of an ion channel, underscoring the importance of studying macromolecules at physiological temperatures. It also provides a potential molecular framework for deciphering how thermosensitive TRPM channels perceive temperature changes. | ||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_44361.map.gz emd_44361.map.gz | 144.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-44361-v30.xml emd-44361-v30.xml emd-44361.xml emd-44361.xml | 22.7 KB 22.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_44361.png emd_44361.png | 91.2 KB | ||
| Filedesc metadata |  emd-44361.cif.gz emd-44361.cif.gz | 6.9 KB | ||
| その他 |  emd_44361_additional_1.map.gz emd_44361_additional_1.map.gz emd_44361_half_map_1.map.gz emd_44361_half_map_1.map.gz emd_44361_half_map_2.map.gz emd_44361_half_map_2.map.gz | 7.7 MB 145.2 MB 145.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-44361 http://ftp.pdbj.org/pub/emdb/structures/EMD-44361 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44361 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44361 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_44361_validation.pdf.gz emd_44361_validation.pdf.gz | 798.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_44361_full_validation.pdf.gz emd_44361_full_validation.pdf.gz | 798.4 KB | 表示 | |
| XML形式データ |  emd_44361_validation.xml.gz emd_44361_validation.xml.gz | 15.5 KB | 表示 | |
| CIF形式データ |  emd_44361_validation.cif.gz emd_44361_validation.cif.gz | 18.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44361 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44361 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44361 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44361 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9b8xMC  9b8wC  9b8yC  9b8zC  9b90C  9b91C  9b92C  9b93C  9b94C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_44361.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_44361.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.828 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
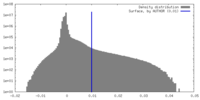
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: #1
| ファイル | emd_44361_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
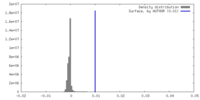
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_44361_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
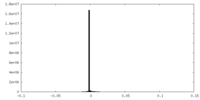
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_44361_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
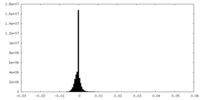
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human TRPM4 channel subunit in complex with calcium 37 degrees Celsius
| 全体 | 名称: human TRPM4 channel subunit in complex with calcium 37 degrees Celsius |
|---|---|
| 要素 |
|
-超分子 #1: human TRPM4 channel subunit in complex with calcium 37 degrees Celsius
| 超分子 | 名称: human TRPM4 channel subunit in complex with calcium 37 degrees Celsius タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Transient receptor potential cation channel subfamily M member 4
| 分子 | 名称: Transient receptor potential cation channel subfamily M member 4 タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 134.456484 KDa |
| 組換発現 | 生物種: Mammalia (両生類) |
| 配列 | 文字列: MVVPEKEQSW IPKIFKKKTC TTFIVDSTDP GGTLCQCGRP RTAHPAVAME DAFGAAVVTV WDSDAHTTEK PTDAYGELDF TGAGRKHSN FLRLSDRTDP AAVYSLVTRT WGFRAPNLVV SVLGGSGGPV LQTWLQDLLR RGLVRAAQST GAWIVTGGLH T GIGRHVGV ...文字列: MVVPEKEQSW IPKIFKKKTC TTFIVDSTDP GGTLCQCGRP RTAHPAVAME DAFGAAVVTV WDSDAHTTEK PTDAYGELDF TGAGRKHSN FLRLSDRTDP AAVYSLVTRT WGFRAPNLVV SVLGGSGGPV LQTWLQDLLR RGLVRAAQST GAWIVTGGLH T GIGRHVGV AVRDHQMAST GGTKVVAMGV APWGVVRNRD TLINPKGSFP ARYRWRGDPE DGVQFPLDYN YSAFFLVDDG TH GCLGGEN RFRLRLESYI SQQKTGVGGT GIDIPVLLLL IDGDEKMLTR IENATQAQLP CLLVAGSGGA ADCLAETLED TLA PGSGGA RQGEARDRIR RFFPKGDLEV LQAQVERIMT RKELLTVYSS EDGSEEFETI VLKALVKACG SSEASAYLDE LRLA VAWNR VDIAQSELFR GDIQWRSFHL EASLMDALLN DRPEFVRLLI SHGLSLGHFL TPMRLAQLYS AAPSNSLIRN LLDQA SHSA GTKAPALKGG AAELRPPDVG HVLRMLLGKM CAPRYPSGGA WDPHPGQGFG ESMYLLSDKA TSPLSLDAGL GQAPWS DLL LWALLLNRAQ MAMYFWEMGS NAVSSALGAC LLLRVMARLE PDAEEAARRK DLAFKFEGMG VDLFGECYRS SEVRAAR LL LRRCPLWGDA TCLQLAMQAD ARAFFAQDGV QSLLTQKWWG DMASTTPIWA LVLAFFCPPL IYTRLITFRK SEEEPTRE E LEFDMDSVIN GEGPVGTADP AEKTPLGVPR QSGRPGCCGG RCGGRRCLRR WFHFWGAPVT IFMGNVVSYL LFLLLFSRV LLVDFQPAPP GSLELLLYFW AFTLLCEELR QGLSGGGGSL ASGGPGPGHA SLSQRLRLYL ADSWNQCDLV ALTCFLLGVG CRLTPGLYH LGRTVLCIDF MVFTVRLLHI FTVNKQLGPK IVIVSKMMKD VFFFLFFLGV WLVAYGVATE GLLRPRDSDF P SILRRVFY RPYLQIFGQI PQEDMDVALM EHSNCSSEPG FWAHPPGAQA GTCVSQYANW LVVLLLVIFL LVANILLVNL LI AMFSYTF GKVQGNSDLY WKAQRYRLIR EFHSRPALAP PFIVISHLRL LLRQLCRRPR SPQPSSPALE HFRVYLSKEA ERK LLTWES VHKENFLLAR ARDKRESDSE RLKRTSQKVD LALKQLGHIR EYEQRLKVLE REVQQCSRVL GWVAEALSRS ALLP PGGPP PPDLPGSKD UniProtKB: Transient receptor potential cation channel subfamily M member 4 |
-分子 #2: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 2 / コピー数: 2 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 1.9000000000000001 µm 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)