+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Ubiquitin E2-Ub-E3 HECT tetrahedral transthiolation intermediate mimic - state 6 | |||||||||
 マップデータ マップデータ | Full map from the gold-standard refinement, globally sharpened using an B-factor of -40 A^2, used for model building and refinement. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | UBIQUITIN / E2 / E3 / HECT / NEDD4 / RSP5 / PUB2 / UBC4 / TRANSTHIOESTERIFICATION / THIOESTER / TRANSTHIOLATION / TETRAHEDRAL INTERMEDIATE / ADENYLATION / INHIBITOR / LIGASE / NUCLEUS / PHOSPHOPROTEIN / UBL CONJUGATION PATHWAY / UBL / ATP ATP-BINDING / AMP / NUCLEOTIDE-BINDING / ISOPEPTIDE BOND | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RHOQ GTPase cycle / RHOU GTPase cycle / Regulation of PTEN localization / Regulation of PTEN stability and activity / cytoplasm to vacuole targeting by the NVT pathway / cell cortex of cell tip / Peroxisomal protein import / E3 ubiquitin ligases ubiquitinate target proteins / nuclear SCF ubiquitin ligase complex / Synthesis of active ubiquitin: roles of E1 and E2 enzymes ...RHOQ GTPase cycle / RHOU GTPase cycle / Regulation of PTEN localization / Regulation of PTEN stability and activity / cytoplasm to vacuole targeting by the NVT pathway / cell cortex of cell tip / Peroxisomal protein import / E3 ubiquitin ligases ubiquitinate target proteins / nuclear SCF ubiquitin ligase complex / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / Antigen processing: Ubiquitination & Proteasome degradation / SREBP signaling pathway / positive regulation of mitotic metaphase/anaphase transition / HECT-type E3 ubiquitin transferase / SCF-dependent proteasomal ubiquitin-dependent protein catabolic process / E2 ubiquitin-conjugating enzyme / cell division site / ubiquitin conjugating enzyme activity / ubiquitin ligase complex / modification-dependent protein catabolic process / protein polyubiquitination / ubiquitin-protein transferase activity / protein tag activity / ubiquitin protein ligase activity / ribosome biogenesis / ubiquitin-dependent protein catabolic process / cytoplasmic translation / cytosolic large ribosomal subunit / structural constituent of ribosome / protein ubiquitination / ubiquitin protein ligase binding / nucleolus / ATP binding / membrane / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.65 Å | |||||||||
 データ登録者 データ登録者 | Kochanczyk T / Lima CD | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Structural basis for transthiolation intermediates in the ubiquitin pathway. 著者: Tomasz Kochańczyk / Zachary S Hann / Michaelyn C Lux / Avelyn Mae V Delos Reyes / Cheng Ji / Derek S Tan / Christopher D Lima /  要旨: Transthiolation (also known as transthioesterification) reactions are used in the biosynthesis of acetyl coenzyme A, fatty acids and polyketides, and for post-translational modification by ubiquitin ...Transthiolation (also known as transthioesterification) reactions are used in the biosynthesis of acetyl coenzyme A, fatty acids and polyketides, and for post-translational modification by ubiquitin (Ub) and ubiquitin-like (Ubl) proteins. For the Ub pathway, E1 enzymes catalyse transthiolation from an E1~Ub thioester to an E2~Ub thioester. Transthiolation is also required for transfer of Ub from an E2~Ub thioester to HECT (homologous to E6AP C terminus) and RBR (ring-between-ring) E3 ligases to form E3~Ub thioesters. How isoenergetic transfer of thioester bonds is driven forward by enzymes in the Ub pathway remains unclear. Here we isolate mimics of transient transthiolation intermediates for E1-Ub(T)-E2 and E2-Ub(T)-E3 complexes (where T denotes Ub in a thioester or Ub undergoing transthiolation) using a chemical strategy with native enzymes and near-native Ub to capture and visualize a continuum of structures determined by single-particle cryo-electron microscopy. These structures and accompanying biochemical experiments illuminate conformational changes in Ub, E1, E2 and E3 that are coordinated with the chemical reactions to facilitate directional transfer of Ub from each enzyme to the next. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_44205.map.gz emd_44205.map.gz | 64.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-44205-v30.xml emd-44205-v30.xml emd-44205.xml emd-44205.xml | 22.6 KB 22.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_44205_fsc.xml emd_44205_fsc.xml | 10.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_44205.png emd_44205.png | 100.5 KB | ||
| Filedesc metadata |  emd-44205.cif.gz emd-44205.cif.gz | 6.7 KB | ||
| その他 |  emd_44205_additional_1.map.gz emd_44205_additional_1.map.gz emd_44205_half_map_1.map.gz emd_44205_half_map_1.map.gz emd_44205_half_map_2.map.gz emd_44205_half_map_2.map.gz | 62.8 MB 116.2 MB 116.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-44205 http://ftp.pdbj.org/pub/emdb/structures/EMD-44205 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44205 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44205 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_44205_validation.pdf.gz emd_44205_validation.pdf.gz | 905.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_44205_full_validation.pdf.gz emd_44205_full_validation.pdf.gz | 904.7 KB | 表示 | |
| XML形式データ |  emd_44205_validation.xml.gz emd_44205_validation.xml.gz | 18.9 KB | 表示 | |
| CIF形式データ |  emd_44205_validation.cif.gz emd_44205_validation.cif.gz | 24.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44205 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44205 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44205 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44205 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9b5aMC  9b55C  9b56C  9b57C  9b58C  9b59C  9b5bC  9b5cC  9b5dC  9b5eC  9b5fC  9b5gC  9b5hC  9b5iC  9b5jC  9b5kC  9b5lC  9b5mC  9b5nC  9b5oC  9b5pC  9b5qC  9b5rC  9b5sC  9b5tC  9b5uC  9b5vC  9b5wC  9b5xC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_44205.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_44205.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Full map from the gold-standard refinement, globally sharpened using an B-factor of -40 A^2, used for model building and refinement. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.064 Å | ||||||||||||||||||||||||||||||||||||
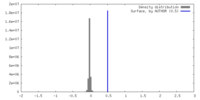
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Full map from the gold-standard refinement (unsharpened).
| ファイル | emd_44205_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Full map from the gold-standard refinement (unsharpened). | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1 from the gold-standard refinement.
| ファイル | emd_44205_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 from the gold-standard refinement. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2 from the gold-standard refinement.
| ファイル | emd_44205_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 from the gold-standard refinement. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Covalent E2-Ub-E3 HECT transthiolation intermediate mimic complex
| 全体 | 名称: Covalent E2-Ub-E3 HECT transthiolation intermediate mimic complex |
|---|---|
| 要素 |
|
-超分子 #1: Covalent E2-Ub-E3 HECT transthiolation intermediate mimic complex
| 超分子 | 名称: Covalent E2-Ub-E3 HECT transthiolation intermediate mimic complex タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1, #3 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Ubiquitin-conjugating enzyme E2 4
| 分子 | 名称: Ubiquitin-conjugating enzyme E2 4 / タイプ: protein_or_peptide / ID: 1 詳細: C-terminal GGLVPR is a residual artifact after thrombin cleavage of affinity tag コピー数: 1 / 光学異性体: LEVO / EC番号: E2 ubiquitin-conjugating enzyme |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 17.043336 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MALKRINREL ADLGKDPPSS SSAGPVGDDL FHWQATIMGP ADSPYAGGVF FLSIHFPTDY PFKPPKVNFT TRIYHPNINS NGSICLDIL RDQWSPALTI SKVLLSISSL LTDPNPDDPL VPEIAHVYKT DRSRYELSAR EWTRKYAIGG LVPR UniProtKB: Ubiquitin-conjugating enzyme E2 4 |
-分子 #2: Ubiquitin
| 分子 | 名称: Ubiquitin / タイプ: protein_or_peptide / ID: 2 詳細: N-terminal GSGG is a residual artifact after TEV protease cleavage of affinity tag コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 8.769948 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSGGMQIFVK TLTGKTITLE VESSDTIDNV KSKIQDKEGI PPDQQRLIFA GKQLEDGRTL SDYNIQKEST LHLVLRLRG UniProtKB: Ubiquitin-ribosomal protein eL40B fusion protein |
-分子 #3: E3 ubiquitin-protein ligase pub2
| 分子 | 名称: E3 ubiquitin-protein ligase pub2 / タイプ: protein_or_peptide / ID: 3 詳細: N-terminal SHM is a residual artifact after cleaving the affinity tag コピー数: 1 / 光学異性体: LEVO / EC番号: HECT-type E3 ubiquitin transferase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 44.231828 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SHMDEYQRKI AYMYDRPEMA VNDAQLQLKV SRATTFEDAY DIISKLSVSD MKKKLLIRFR NEDGLDYGGV SREFFYILSH AIFNPGYSL FEYATDDNYG LQISPLSSVN PDFRSYFRFV GRVMGLAIYH RRYLDVQFVL PFYKRILQKP LCLEDVKDVD E VYYESLKW ...文字列: SHMDEYQRKI AYMYDRPEMA VNDAQLQLKV SRATTFEDAY DIISKLSVSD MKKKLLIRFR NEDGLDYGGV SREFFYILSH AIFNPGYSL FEYATDDNYG LQISPLSSVN PDFRSYFRFV GRVMGLAIYH RRYLDVQFVL PFYKRILQKP LCLEDVKDVD E VYYESLKW IKNNDVDESL CLNFSVEENR FGESVTVDLI PNGRNIAVNN QNKMNYLKAL TEHKLVTSTE EQFNALKGGL NE LIPDSVL QIFNENELDT LLNGKRDIDV QDWKRFTDYR SYTETDDIVI WFWELLSEWS PEKKAKLLQF ATGTSRLPLS GFK DMHGSD GPRKFTIEKV GHISQLPKAH TCFNRLDIPP YNSKEELEQK LTIAIQETAG FGTE UniProtKB: E3 ubiquitin-protein ligase pub2 |
-分子 #4: 4-aminobutanenitrile
| 分子 | 名称: 4-aminobutanenitrile / タイプ: ligand / ID: 4 / コピー数: 1 / 式: A1AIV |
|---|---|
| 分子量 | 理論値: 84.12 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.5 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.2 構成要素:
詳細: 20 mM Tris-HCl, 100 mM NaCl, 0.1% CHAPSO | ||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 検出モード: SUPER-RESOLUTION / 平均露光時間: 4.0 sec. / 平均電子線量: 72.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-9b5a: |
 ムービー
ムービー コントローラー
コントローラー







































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)