+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4287 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human R2TP subcomplex containing 1 RUVBL1-RUVBL2 hexamer bound to 1 RBD domain from RPAP3. | ||||||||||||
 マップデータ マップデータ | Structure of a human R2TP subcomplex, comprising a RUVBL1-RUVBL2 hexamer bound to one RBD domain of RPAP3 | ||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報promoter-enhancer loop anchoring activity / regulation of DNA strand elongation / positive regulation of telomere maintenance in response to DNA damage / establishment of protein localization to chromatin / R2TP complex / dynein axonemal particle / RPAP3/R2TP/prefoldin-like complex / Swr1 complex / regulation of double-strand break repair / positive regulation of telomerase RNA localization to Cajal body ...promoter-enhancer loop anchoring activity / regulation of DNA strand elongation / positive regulation of telomere maintenance in response to DNA damage / establishment of protein localization to chromatin / R2TP complex / dynein axonemal particle / RPAP3/R2TP/prefoldin-like complex / Swr1 complex / regulation of double-strand break repair / positive regulation of telomerase RNA localization to Cajal body / Ino80 complex / protein folding chaperone complex / box C/D snoRNP assembly / regulation of chromosome organization / NuA4 histone acetyltransferase complex / regulation of DNA replication / TFIID-class transcription factor complex binding / regulation of embryonic development / MLL1 complex / Telomere Extension By Telomerase / positive regulation of double-strand break repair via homologous recombination / RNA polymerase II core promoter sequence-specific DNA binding / regulation of DNA repair / DNA helicase activity / Deposition of new CENPA-containing nucleosomes at the centromere / positive regulation of DNA repair / TBP-class protein binding / telomere maintenance / cellular response to estradiol stimulus / Formation of the beta-catenin:TCF transactivating complex / DNA Damage Recognition in GG-NER / euchromatin / negative regulation of canonical Wnt signaling pathway / chromatin DNA binding / ADP binding / beta-catenin binding / nuclear matrix / transcription corepressor activity / UCH proteinases / cellular response to UV / nucleosome / unfolded protein binding / positive regulation of canonical Wnt signaling pathway / protein folding / HATs acetylate histones / ATPase binding / spermatogenesis / regulation of apoptotic process / DNA recombination / DNA helicase / transcription coactivator activity / protein stabilization / regulation of cell cycle / Ub-specific processing proteases / chromatin remodeling / ribonucleoprotein complex / cadherin binding / cell cycle / RNA polymerase II cis-regulatory region sequence-specific DNA binding / cell division / DNA repair / centrosome / regulation of DNA-templated transcription / regulation of transcription by RNA polymerase II / positive regulation of DNA-templated transcription / protein homodimerization activity / ATP hydrolysis activity / positive regulation of transcription by RNA polymerase II / extracellular exosome / nucleoplasm / ATP binding / identical protein binding / membrane / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
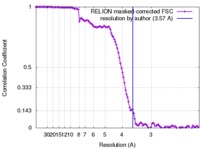
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.57 Å | ||||||||||||
 データ登録者 データ登録者 | Martino F / Munoz-Hernandez H / Rodriguez CF / Pearl LH / Llorca O | ||||||||||||
| 資金援助 |  スペイン, 3件 スペイン, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2018 ジャーナル: Nat Commun / 年: 2018タイトル: RPAP3 provides a flexible scaffold for coupling HSP90 to the human R2TP co-chaperone complex. 著者: Fabrizio Martino / Mohinder Pal / Hugo Muñoz-Hernández / Carlos F Rodríguez / Rafael Núñez-Ramírez / David Gil-Carton / Gianluca Degliesposti / J Mark Skehel / S Mark Roe / Chrisostomos ...著者: Fabrizio Martino / Mohinder Pal / Hugo Muñoz-Hernández / Carlos F Rodríguez / Rafael Núñez-Ramírez / David Gil-Carton / Gianluca Degliesposti / J Mark Skehel / S Mark Roe / Chrisostomos Prodromou / Laurence H Pearl / Oscar Llorca /   要旨: The R2TP/Prefoldin-like co-chaperone, in concert with HSP90, facilitates assembly and cellular stability of RNA polymerase II, and complexes of PI3-kinase-like kinases such as mTOR. However, the ...The R2TP/Prefoldin-like co-chaperone, in concert with HSP90, facilitates assembly and cellular stability of RNA polymerase II, and complexes of PI3-kinase-like kinases such as mTOR. However, the mechanism by which this occurs is poorly understood. Here we use cryo-EM and biochemical studies on the human R2TP core (RUVBL1-RUVBL2-RPAP3-PIH1D1) which reveal the distinctive role of RPAP3, distinguishing metazoan R2TP from the smaller yeast equivalent. RPAP3 spans both faces of a single RUVBL ring, providing an extended scaffold that recruits clients and provides a flexible tether for HSP90. A 3.6 Å cryo-EM structure reveals direct interaction of a C-terminal domain of RPAP3 and the ATPase domain of RUVBL2, necessary for human R2TP assembly but absent from yeast. The mobile TPR domains of RPAP3 map to the opposite face of the ring, associating with PIH1D1, which mediates client protein recruitment. Thus, RPAP3 provides a flexible platform for bringing HSP90 into proximity with diverse client proteins. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4287.map.gz emd_4287.map.gz | 7.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4287-v30.xml emd-4287-v30.xml emd-4287.xml emd-4287.xml | 17.4 KB 17.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4287_fsc.xml emd_4287_fsc.xml | 11.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4287.png emd_4287.png | 58.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4287 http://ftp.pdbj.org/pub/emdb/structures/EMD-4287 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4287 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4287 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4287_validation.pdf.gz emd_4287_validation.pdf.gz | 246 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4287_full_validation.pdf.gz emd_4287_full_validation.pdf.gz | 245.1 KB | 表示 | |
| XML形式データ |  emd_4287_validation.xml.gz emd_4287_validation.xml.gz | 12.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4287 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4287 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4287 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4287 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4287.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4287.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Structure of a human R2TP subcomplex, comprising a RUVBL1-RUVBL2 hexamer bound to one RBD domain of RPAP3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : a human R2TP subcomplex containing 1 RUVBL1-RUVBL2 hexamer bound ...
| 全体 | 名称: a human R2TP subcomplex containing 1 RUVBL1-RUVBL2 hexamer bound to 1 RBD domain of RPAP3 |
|---|---|
| 要素 |
|
-超分子 #1: a human R2TP subcomplex containing 1 RUVBL1-RUVBL2 hexamer bound ...
| 超分子 | 名称: a human R2TP subcomplex containing 1 RUVBL1-RUVBL2 hexamer bound to 1 RBD domain of RPAP3 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-分子 #1: RuvB-like 1
| 分子 | 名称: RuvB-like 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO / EC番号: DNA helicase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 50.296914 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKIEEVKSTT KTQRIASHSH VKGLGLDESG LAKQAASGLV GQENAREACG VIVELIKSKK MAGRAVLLAG PPGTGKTALA LAIAQELGS KVPFCPMVGS EVYSTEIKKT EVLMENFRRA IGLRIKETKE VYEGEVTELT PCETENPMGG YGKTISHVII G LKTAKGTK ...文字列: MKIEEVKSTT KTQRIASHSH VKGLGLDESG LAKQAASGLV GQENAREACG VIVELIKSKK MAGRAVLLAG PPGTGKTALA LAIAQELGS KVPFCPMVGS EVYSTEIKKT EVLMENFRRA IGLRIKETKE VYEGEVTELT PCETENPMGG YGKTISHVII G LKTAKGTK QLKLDPSIFE SLQKERVEAG DVIYIEANSG AVKRQGRCDT YATEFDLEAE EYVPLPKGDV HKKKEIIQDV TL HDLDVAN ARPQGGQDIL SMMGQLMKPK KTEITDKLRG EINKVVNKYI DQGIAELVPG VLFVDEVHML DIECFTYLHR ALE SSIAPI VIFASNRGNC VIRGTEDITS PHGIPLDLLD RVMIIRTMLY TPQEMKQIIK IRAQTEGINI SEEALNHLGE IGTK TTLRY SVQLLTPANL LAKINGKDSI EKEHVEEISE LFYDAKSSAK ILADQQDKYM K |
-分子 #2: RuvB-like 2
| 分子 | 名称: RuvB-like 2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 3 / 光学異性体: LEVO / EC番号: DNA helicase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 51.222465 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MATVTATTKV PEIRDVTRIE RIGAHSHIRG LGLDDALEPR QASQGMVGQL AARRAAGVVL EMIREGKIAG RAVLIAGQPG TGKTAIAMG MAQALGPDTP FTAIAGSEIF SLEMSKTEAL TQAFRRSIGV RIKEETEIIE GEVVEIQIDR PATGTGSKVG K LTLKTTEM ...文字列: MATVTATTKV PEIRDVTRIE RIGAHSHIRG LGLDDALEPR QASQGMVGQL AARRAAGVVL EMIREGKIAG RAVLIAGQPG TGKTAIAMG MAQALGPDTP FTAIAGSEIF SLEMSKTEAL TQAFRRSIGV RIKEETEIIE GEVVEIQIDR PATGTGSKVG K LTLKTTEM ETIYDLGTKM IESLTKDKVQ AGDVITIDKA TGKISKLGRS FTRARDYDAM GSQTKFVQCP DGELQKRKEV VH TVSLHEI DVINSRTQGF LALFSGDTGE IKSEVREQIN AKVAEWREEG KAEIIPGVLF IDEVHMLDIE SFSFLNRALE SDM APVLIM ATNRGITRIR GTSYQSPHGI PIDLLDRLLI VSTTPYSEKD TKQILRIRCE EEDVEMSEDA YTVLTRIGLE TSLR YAIQL ITAASLVCRK RKGTEVQVDD IKRVYSLFLD ESRSTQYMKE YQDAFLFNEL KGETMDTS |
-分子 #3: RNA polymerase II-associated protein 3
| 分子 | 名称: RNA polymerase II-associated protein 3 / タイプ: protein_or_peptide / ID: 3 詳細: MTSANKAIELQLQVKQNAEELQDFMRDLENWEKDIKQKDMELRRQNGVPEENLPPIRNGN FRKKKKGKAKESSKKTREENTKNRIKSYDYEAWAKLDVDRILDELDKDDSTHESLSQESE SEEDGIHVDSQKALVLKEKGNKYFKQGKYDEAIDCYTKGMDADPYNPVLPTNRASAYFRL ...詳細: MTSANKAIELQLQVKQNAEELQDFMRDLENWEKDIKQKDMELRRQNGVPEENLPPIRNGN FRKKKKGKAKESSKKTREENTKNRIKSYDYEAWAKLDVDRILDELDKDDSTHESLSQESE SEEDGIHVDSQKALVLKEKGNKYFKQGKYDEAIDCYTKGMDADPYNPVLPTNRASAYFRL KKFAVAESDCNLAVALNRSYTKAYSRRGAARFALQKLEEAKKDYERVLELEPNNFEATNE LRKISQALASKENSYPKEADIVIKSTEGERKQIEAQQNKQQAISEKDRGNGFFKEGKYER AIECYTRGIAADGANALLPANRAMAYLKIQKYEEAEKDCTQAILLDGSYSKAFARRGTAR TFLGKLNEAKQDFETVLLLEPGNKQAVTELSKIKKELIEKGHWDDVFLDSTQRQNVVKPI DNPPHPGSTKPLKKVIIEETGNLIQTIDVPDSTTAAAPENNPINLANVIAATGTTSKKNS SQDDLFPTSDTPRAKVLKIEEVSDTSSLQPQASLKQDVCQSYSEKMPIEIEQKPAQFATT VLPPIPANSFQLESDFRQLKSSPDMLYQYLKQIEPSLYPKLFQKNLDPDVFNQIVKILHD FYIEKEKPLLIFEILQRLSELKRFDMAVMFMSETEKKIARALFNHIDKSGLKDSSVEELK KRYGG コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 75.830547 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTSANKAIEL QLQVKQNAEE LQDFMRDLEN WEKDIKQKDM ELRRQNGVPE ENLPPIRNGN FRKKKKGKAK ESSKKTREEN TKNRIKSYD YEAWAKLDVD RILDELDKDD STHESLSQES ESEEDGIHVD SQKALVLKEK GNKYFKQGKY DEAIDCYTKG M DADPYNPV ...文字列: MTSANKAIEL QLQVKQNAEE LQDFMRDLEN WEKDIKQKDM ELRRQNGVPE ENLPPIRNGN FRKKKKGKAK ESSKKTREEN TKNRIKSYD YEAWAKLDVD RILDELDKDD STHESLSQES ESEEDGIHVD SQKALVLKEK GNKYFKQGKY DEAIDCYTKG M DADPYNPV LPTNRASAYF RLKKFAVAES DCNLAVALNR SYTKAYSRRG AARFALQKLE EAKKDYERVL ELEPNNFEAT NE LRKISQA LASKENSYPK EADIVIKSTE GERKQIEAQQ NKQQAISEKD RGNGFFKEGK YERAIECYTR GIAADGANAL LPA NRAMAY LKIQKYEEAE KDCTQAILLD GSYSKAFARR GTARTFLGKL NEAKQDFETV LLLEPGNKQA VTELSKIKKE LIEK GHWDD VFLDSTQRQN VVKPIDNPPH PGSTKPLKKV IIEETGNLIQ TIDVPDSTTA AAPENNPINL ANVIAATGTT SKKNS SQDD LFPTSDTPRA KVLKIEEVSD TSSLQPQASL KQDVCQSYSE KMPIEIEQKP AQFATTVLPP IPANSFQLES DFRQLK SSP DMLYQYLKQI EPSLYPKLFQ KNLDPDVFNQ IVKILHDFYI EKEKPLLIFE ILQRLSELKR FDMAVMFMSE TEKKIAR AL FNHIDKSGLK DSSVEELKKR YGG |
-分子 #4: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 6 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.8 構成要素:
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-6fo1: |
 ムービー
ムービー コントローラー
コントローラー