+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM Structure of Allosterically Switchable De Novo Protein sr322, In Closed State without Effector Peptide, off Target Multimeric State | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Allosterically Switchable Protein / sr322 / closed state / DE NOVO PROTEIN | |||||||||
| 生物種 | synthetic construct (人工物) | |||||||||
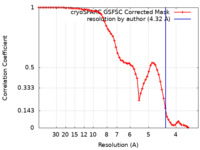
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.32 Å | |||||||||
 データ登録者 データ登録者 | Weidle C / Borst A | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: De novo design of allosterically switchable protein assemblies. 著者: Arvind Pillai / Abbas Idris / Annika Philomin / Connor Weidle / Rebecca Skotheim / Philip J Y Leung / Adam Broerman / Cullen Demakis / Andrew J Borst / Florian Praetorius / David Baker /   要旨: Allosteric modulation of protein function, wherein the binding of an effector to a protein triggers conformational changes at distant functional sites, plays a central part in the control of ...Allosteric modulation of protein function, wherein the binding of an effector to a protein triggers conformational changes at distant functional sites, plays a central part in the control of metabolism and cell signalling. There has been considerable interest in designing allosteric systems, both to gain insight into the mechanisms underlying such 'action at a distance' modulation and to create synthetic proteins whose functions can be regulated by effectors. However, emulating the subtle conformational changes distributed across many residues, characteristic of natural allosteric proteins, is a significant challenge. Here, inspired by the classic Monod-Wyman-Changeux model of cooperativity, we investigate the de novo design of allostery through rigid-body coupling of peptide-switchable hinge modules to protein interfaces that direct the formation of alternative oligomeric states. We find that this approach can be used to generate a wide variety of allosterically switchable systems, including cyclic rings that incorporate or eject subunits in response to peptide binding and dihedral cages that undergo effector-induced disassembly. Size-exclusion chromatography, mass photometry and electron microscopy reveal that these designed allosteric protein assemblies closely resemble the design models in both the presence and absence of peptide effectors and can have ligand-binding cooperativity comparable to classic natural systems such as haemoglobin. Our results indicate that allostery can arise from global coupling of the energetics of protein substructures without optimized side-chain-side-chain allosteric communication pathways and provide a roadmap for generating allosterically triggerable delivery systems, protein nanomachines and cellular feedback control circuitry. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42542.map.gz emd_42542.map.gz | 27.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42542-v30.xml emd-42542-v30.xml emd-42542.xml emd-42542.xml | 17.3 KB 17.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_42542_fsc.xml emd_42542_fsc.xml | 6.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_42542.png emd_42542.png | 81.5 KB | ||
| Filedesc metadata |  emd-42542.cif.gz emd-42542.cif.gz | 6.1 KB | ||
| その他 |  emd_42542_half_map_1.map.gz emd_42542_half_map_1.map.gz emd_42542_half_map_2.map.gz emd_42542_half_map_2.map.gz | 28.2 MB 28.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42542 http://ftp.pdbj.org/pub/emdb/structures/EMD-42542 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42542 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42542 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42542_validation.pdf.gz emd_42542_validation.pdf.gz | 653.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42542_full_validation.pdf.gz emd_42542_full_validation.pdf.gz | 653.3 KB | 表示 | |
| XML形式データ |  emd_42542_validation.xml.gz emd_42542_validation.xml.gz | 13.7 KB | 表示 | |
| CIF形式データ |  emd_42542_validation.cif.gz emd_42542_validation.cif.gz | 17.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42542 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42542 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42542 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42542 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42542.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42542.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.68 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_42542_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
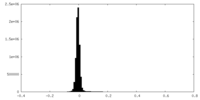
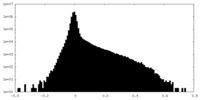
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_42542_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
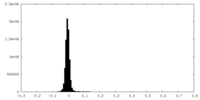
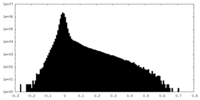
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : sr322
| 全体 | 名称: sr322 |
|---|---|
| 要素 |
|
-超分子 #1: sr322
| 超分子 | 名称: sr322 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Complex is made up of 4 monomeric proteins, and is purified as a 4 sided multimer sr322. In this structure two copies of sr322 interact in an off target way. |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 326.592 KDa |
-分子 #1: de novo protein sr322
| 分子 | 名称: de novo protein sr322 / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 40.089242 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SGTVTFDITN ISHKAIDIIL KVVLGIAEHE GTEVTFHSER GQLQIEVKNL HEEDKRLIEQ AIEAARLADS PDPESVARAV ELLTKVAKA STNTELIQFI VKELLELARK LTDPKDLAKV LDSISELLTE LALKTGDPTA ALAAMVAHIA ELVVRLALMA E RTHPGSEI ...文字列: SGTVTFDITN ISHKAIDIIL KVVLGIAEHE GTEVTFHSER GQLQIEVKNL HEEDKRLIEQ AIEAARLADS PDPESVARAV ELLTKVAKA STNTELIQFI VKELLELARK LTDPKDLAKV LDSISELLTE LALKTGDPTA ALAAMVAHIA ELVVRLALMA E RTHPGSEI VKKAVKLVQE VAEEVLEAAQ LMLEKPNSDE VAKKLEEVAK KAIEACIELQ QILEAWAKER GDQDLLREVR EH KLQILTI AVAYKAAQMG VTVLKHTHGW VVFLVILGLH KQQAEQLLRF VHRVAHALGV TLSITFSGDI VVIAVTVGAS EEE KKEVRK IVKEIAKQLR HAETEEEAKE IVQRVIEEWQ EEGGSG |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.971 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: 150 mM NaCl, 40 mM Tris pH 8.0 | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 4213 / 平均露光時間: 5.0 sec. / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | Chain - Initial model type: in silico model |
|---|---|
| 詳細 | Initial fit was done using Chimera using Rigid body from In silico model. Then Isolde and Namdinator were used. Coot and Phenix were also used. |
| 精密化 | プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-8utm: |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)