+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The structure of the PP2A-B56Delta holoenzyme mutant - E197K | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | complex / phosphatase / CELL CYCLE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報meiotic spindle elongation / Integration of energy metabolism / PP2A-mediated dephosphorylation of key metabolic factors / regulation of microtubule binding / MASTL Facilitates Mitotic Progression / mitotic sister chromatid separation / regulation of meiotic cell cycle process involved in oocyte maturation / protein phosphatase type 2A complex / meiotic sister chromatid cohesion, centromeric / peptidyl-serine dephosphorylation ...meiotic spindle elongation / Integration of energy metabolism / PP2A-mediated dephosphorylation of key metabolic factors / regulation of microtubule binding / MASTL Facilitates Mitotic Progression / mitotic sister chromatid separation / regulation of meiotic cell cycle process involved in oocyte maturation / protein phosphatase type 2A complex / meiotic sister chromatid cohesion, centromeric / peptidyl-serine dephosphorylation / peptidyl-threonine dephosphorylation / positive regulation of microtubule binding / Regulation of glycolysis by fructose 2,6-bisphosphate metabolism / Inhibition of replication initiation of damaged DNA by RB1/E2F1 / female meiotic nuclear division / protein antigen binding / protein phosphatase regulator activity / GABA receptor binding / APC truncation mutants have impaired AXIN binding / AXIN missense mutants destabilize the destruction complex / Truncations of AMER1 destabilize the destruction complex / Initiation of Nuclear Envelope (NE) Reformation / ERKs are inactivated / positive regulation of extrinsic apoptotic signaling pathway in absence of ligand / Beta-catenin phosphorylation cascade / Signaling by GSK3beta mutants / CTNNB1 S33 mutants aren't phosphorylated / CTNNB1 S37 mutants aren't phosphorylated / CTNNB1 S45 mutants aren't phosphorylated / CTNNB1 T41 mutants aren't phosphorylated / negative regulation of epithelial to mesenchymal transition / regulation of growth / Disassembly of the destruction complex and recruitment of AXIN to the membrane / negative regulation of glycolytic process through fructose-6-phosphate / positive regulation of NLRP3 inflammasome complex assembly / myosin phosphatase activity / CTLA4 inhibitory signaling / protein serine/threonine phosphatase activity / Platelet sensitization by LDL / protein-serine/threonine phosphatase / negative regulation of peptidyl-threonine phosphorylation / regulation of cell differentiation / ERK/MAPK targets / T cell homeostasis / protein phosphatase activator activity / regulation of G1/S transition of mitotic cell cycle / mesoderm development / phosphoprotein phosphatase activity / chromosome, centromeric region / DARPP-32 events / lateral plasma membrane / negative regulation of phosphatidylinositol 3-kinase/protein kinase B signal transduction / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / Cyclin A/B1/B2 associated events during G2/M transition / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / positive regulation of protein dephosphorylation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / Anchoring of the basal body to the plasma membrane / AURKA Activation by TPX2 / protein dephosphorylation / meiotic cell cycle / protein tyrosine phosphatase activity / chromosome segregation / RHO GTPases Activate Formins / response to lead ion / Spry regulation of FGF signaling / RAF activation / regulation of protein phosphorylation / Degradation of beta-catenin by the destruction complex / PKR-mediated signaling / tau protein binding / positive regulation of protein serine/threonine kinase activity / spindle pole / Negative regulation of MAPK pathway / Separation of Sister Chromatids / Cyclin D associated events in G1 / microtubule cytoskeleton / Regulation of PLK1 Activity at G2/M Transition / Regulation of TP53 Degradation / nervous system development / mitotic cell cycle / PI5P, PP2A and IER3 Regulate PI3K/AKT Signaling / protein-containing complex assembly / intracellular signal transduction / neuron projection / membrane raft / protein heterodimerization activity / neuronal cell body / glutamatergic synapse / synapse / dendrite / signal transduction / mitochondrion / extracellular exosome 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||
 データ登録者 データ登録者 | Wu CG / Xing Y | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2024 ジャーナル: Proc Natl Acad Sci U S A / 年: 2024タイトル: B56δ long-disordered arms form a dynamic PP2A regulation interface coupled with global allostery and Jordan's syndrome mutations. 著者: Cheng-Guo Wu / Vijaya K Balakrishnan / Ronald A Merrill / Pankaj S Parihar / Kirill Konovolov / Yu-Chia Chen / Zhen Xu / Hui Wei / Ramya Sundaresan / Qiang Cui / Brian E Wadzinski / Mark R ...著者: Cheng-Guo Wu / Vijaya K Balakrishnan / Ronald A Merrill / Pankaj S Parihar / Kirill Konovolov / Yu-Chia Chen / Zhen Xu / Hui Wei / Ramya Sundaresan / Qiang Cui / Brian E Wadzinski / Mark R Swingle / Alla Musiyenko / Wendy K Chung / Richard E Honkanen / Aussie Suzuki / Xuhui Huang / Stefan Strack / Yongna Xing /  要旨: Intrinsically disordered regions (IDR) and short linear motifs (SLiMs) play pivotal roles in the intricate signaling networks governed by phosphatases and kinases. B56δ (encoded by ) is a regulatory ...Intrinsically disordered regions (IDR) and short linear motifs (SLiMs) play pivotal roles in the intricate signaling networks governed by phosphatases and kinases. B56δ (encoded by ) is a regulatory subunit of protein phosphatase 2A (PP2A) with long IDRs that harbor a substrate-mimicking SLiM and multiple phosphorylation sites. De novo missense mutations in cause intellectual disabilities (ID), macrocephaly, Parkinsonism, and a broad range of neurological symptoms. Our single-particle cryo-EM structures of the PP2A-B56δ holoenzyme reveal that the long, disordered arms at the B56δ termini fold against each other and the holoenzyme core. This architecture suppresses both the phosphatase active site and the substrate-binding protein groove, thereby stabilizing the enzyme in a closed latent form with dual autoinhibition. The resulting interface spans over 190 Å and harbors unfavorable contacts, activation phosphorylation sites, and nearly all residues with ID-associated mutations. Our studies suggest that this dynamic interface is coupled to an allosteric network responsive to phosphorylation and altered globally by mutations. Furthermore, we found that ID mutations increase the holoenzyme activity and perturb the phosphorylation rates, and the severe variants significantly increase the mitotic duration and error rates compared to the normal variant. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42018.map.gz emd_42018.map.gz | 59.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42018-v30.xml emd-42018-v30.xml emd-42018.xml emd-42018.xml | 19.1 KB 19.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_42018.png emd_42018.png | 44.6 KB | ||
| Filedesc metadata |  emd-42018.cif.gz emd-42018.cif.gz | 6.9 KB | ||
| その他 |  emd_42018_half_map_1.map.gz emd_42018_half_map_1.map.gz emd_42018_half_map_2.map.gz emd_42018_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42018 http://ftp.pdbj.org/pub/emdb/structures/EMD-42018 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42018 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42018 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42018_validation.pdf.gz emd_42018_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42018_full_validation.pdf.gz emd_42018_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_42018_validation.xml.gz emd_42018_validation.xml.gz | 12.3 KB | 表示 | |
| CIF形式データ |  emd_42018_validation.cif.gz emd_42018_validation.cif.gz | 14.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42018 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42018 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42018 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42018 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8u89MC  8u1xC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42018.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42018.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.068 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_42018_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
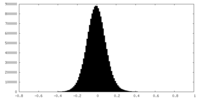
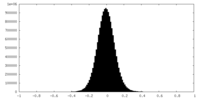
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_42018_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
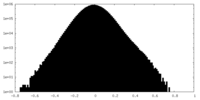
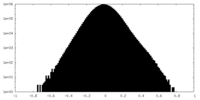
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Protein Phosphatase 2A B56 Delta holoenzyme mutant - E197K
| 全体 | 名称: Protein Phosphatase 2A B56 Delta holoenzyme mutant - E197K |
|---|---|
| 要素 |
|
-超分子 #1: Protein Phosphatase 2A B56 Delta holoenzyme mutant - E197K
| 超分子 | 名称: Protein Phosphatase 2A B56 Delta holoenzyme mutant - E197K タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit...
| 分子 | 名称: Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 65.378344 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MAAADGDDSL YPIAVLIDEL RNEDVQLRLN SIKKLSTIAL ALGVERTRSE LLPFLTDTIY DEDEVLLALA EQLGTFTTLV GGPEYVHCL LPPLESLATV EETVVRDKAV ESLRAISHEH SPSDLEAHFV PLVKRLAGGD WFTSRTSACG LFSVCYPRVS S AVKAELRQ ...文字列: MAAADGDDSL YPIAVLIDEL RNEDVQLRLN SIKKLSTIAL ALGVERTRSE LLPFLTDTIY DEDEVLLALA EQLGTFTTLV GGPEYVHCL LPPLESLATV EETVVRDKAV ESLRAISHEH SPSDLEAHFV PLVKRLAGGD WFTSRTSACG LFSVCYPRVS S AVKAELRQ YFRNLCSDDT PMVRRAAASK LGEFAKVLEL DNVKSEIIPM FSNLASDEQD SVRLLAVEAC VNIAQLLPQE DL EALVMPT LRQAAEDKSW RVRYMVADKF TELQKAVGPE ITKTDLVPAF QNLMKDCEAE VRAAASHKVK EFCENLSADC REN VIMSQI LPCIKELVSD ANQHVKSALA SVIMGLSPIL GKDNTIEHLL PLFLAQLKDE CPEVRLNIIS NLDCVNEVIG IRQL SQSLL PAIVELAEDA KWRVRLAIIE YMPLLAGQLG VEFFDEKLNS LCMAWLVDHV YAIREAATSN LKKLVEKFGK EWAHA TIIP KVLAMSGDPN YLHRMTTLFC INVLSEVCGQ DITTKHMLPT VLRMAGDPVA NVRFNVAKSL QKIGPILDNS TLQSEV KPI LEKLTQDQDV DVKYFAQEAL TVLSLA UniProtKB: Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform |
-分子 #2: Serine/threonine-protein phosphatase 2A 56 kDa regulatory subunit...
| 分子 | 名称: Serine/threonine-protein phosphatase 2A 56 kDa regulatory subunit delta isoform タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 70.089742 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MPYKLKKEKE PPKVAKCTAK PSSSGKDGGG ENTEEAQPQP QPQPQPQAQS QPPSSNKRPS NSTPPPTQLS KIKYSGGPQI VKKERRQSS SRFNLSKNRE LQKLPALKDS PTQEREELFI QKLRQCCVLF DFVSDPLSDL KFKEVKRAGL NEMVEYITHS R DVVTEAIY ...文字列: MPYKLKKEKE PPKVAKCTAK PSSSGKDGGG ENTEEAQPQP QPQPQPQAQS QPPSSNKRPS NSTPPPTQLS KIKYSGGPQI VKKERRQSS SRFNLSKNRE LQKLPALKDS PTQEREELFI QKLRQCCVLF DFVSDPLSDL KFKEVKRAGL NEMVEYITHS R DVVTEAIY PEAVTMFSVN LFRTLPPSSN PTGAEFDPKE DEPTLEAAWP HLQLVYEFFL RFLESPDFQP NIAKKYIDQK FV LALLDLF DSEDPRERDF LKTILHRIYG KFLGLRAYIR RQINHIFYRF IYETEHHNGI AELLEILGSI INGFALPLKE EHK MFLIRV LLPLHKVKSL SVYHPQLAYC VVQFLEKESS LTEPVIVGLL KFWPKTHSPK EVMFLNELEE ILDVIEPSEF SKVM EPLFR QLAKCVSSPH FQVAERALYY WNNEYIMSLI SDNAARVLPI MFPALYRNSK SHWNKTIHGL IYNALKLFME MNQKL FDDC TQQYKAEKQK GRFRMKEREE MWQKIEELAR LNPQYPMFRA PPPLPPVYSM ETETPTAEDI QLLKRTVETE AVQMLK DIK KEKVLLRRKS ELPQDVYTIK ALEAHKRAEE FLTASQEAL UniProtKB: Serine/threonine-protein phosphatase 2A 56 kDa regulatory subunit delta isoform |
-分子 #3: Serine/threonine-protein phosphatase 2A catalytic subunit alpha i...
| 分子 | 名称: Serine/threonine-protein phosphatase 2A catalytic subunit alpha isoform タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO / EC番号: protein-serine/threonine phosphatase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 35.636152 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MDEKVFTKEL DQWIEQLNEC KQLSESQVKS LCEKAKEILT KESNVQEVRC PVTVCGDVHG QFHDLMELFR IGGKSPDTNY LFMGDYVDR GYYSVETVTL LVALKVRYRE RITILRGNHE SRQITQVYGF YDECLRKYGN ANVWKYFTDL FDYLPLTALV D GQIFCLHG ...文字列: MDEKVFTKEL DQWIEQLNEC KQLSESQVKS LCEKAKEILT KESNVQEVRC PVTVCGDVHG QFHDLMELFR IGGKSPDTNY LFMGDYVDR GYYSVETVTL LVALKVRYRE RITILRGNHE SRQITQVYGF YDECLRKYGN ANVWKYFTDL FDYLPLTALV D GQIFCLHG GLSPSIDTLD HIRALDRLQE VPHEGPMCDL LWSDPDDRGG WGISPRGAGY TFGQDISETF NHANGLTLVS RA HQLVMEG YNWCHDRNVV TIFSAPNYCY RCGNQAAIME LDDTLKYSFL QFDPAPRRGE PHVTRRTPDY FL UniProtKB: Serine/threonine-protein phosphatase 2A catalytic subunit alpha isoform |
-分子 #4: MANGANESE (II) ION
| 分子 | 名称: MANGANESE (II) ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: MN |
|---|---|
| 分子量 | 理論値: 54.938 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 49.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER / 詳細: Ab initio model generated by cryoSparc |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 276448 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 3.0) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー























 Z
Z Y
Y X
X