+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Actin 1 from T. gondii in filaments bound to MgADP | |||||||||
 マップデータ マップデータ | T. gondii Act1; Density Modified Map from Helical Reconstruction | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Actin / cytoskeleton / toxoplasmosis / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / cytoskeleton / hydrolase activity / ATP binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.5 Å | |||||||||
 データ登録者 データ登録者 | Hvorecny KL / Sladewski TE / Heaslip AT / Kollman JM | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Toxoplasma gondii actin filaments are tuned for rapid disassembly and turnover. 著者: Kelli L Hvorecny / Thomas E Sladewski / Enrique M De La Cruz / Justin M Kollman / Aoife T Heaslip /  要旨: The cytoskeletal protein actin plays a critical role in the pathogenicity of the intracellular parasite, Toxoplasma gondii, mediating invasion and egress, cargo transport, and organelle inheritance. ...The cytoskeletal protein actin plays a critical role in the pathogenicity of the intracellular parasite, Toxoplasma gondii, mediating invasion and egress, cargo transport, and organelle inheritance. Advances in live cell imaging have revealed extensive filamentous actin networks in the Apicomplexan parasite, but there are conflicting data regarding the biochemical and biophysical properties of Toxoplasma actin. Here, we imaged the in vitro assembly of individual Toxoplasma actin filaments in real time, showing that native, unstabilized filaments grow tens of microns in length. Unlike skeletal muscle actin, Toxoplasma filaments intrinsically undergo rapid treadmilling due to a high critical concentration, fast monomer dissociation, and rapid nucleotide exchange. Cryo-EM structures of jasplakinolide-stabilized and native (i.e. unstabilized) filaments show an architecture like skeletal actin, with differences in assembly contacts in the D-loop that explain the dynamic nature of the filament, likely a conserved feature of Apicomplexan actin. This work demonstrates that evolutionary changes at assembly interfaces can tune the dynamic properties of actin filaments without disrupting their conserved structure. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41583.map.gz emd_41583.map.gz | 25.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41583-v30.xml emd-41583-v30.xml emd-41583.xml emd-41583.xml | 22.9 KB 22.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_41583.png emd_41583.png | 107.5 KB | ||
| Filedesc metadata |  emd-41583.cif.gz emd-41583.cif.gz | 6.1 KB | ||
| その他 |  emd_41583_additional_1.map.gz emd_41583_additional_1.map.gz emd_41583_additional_2.map.gz emd_41583_additional_2.map.gz emd_41583_additional_3.map.gz emd_41583_additional_3.map.gz emd_41583_half_map_1.map.gz emd_41583_half_map_1.map.gz emd_41583_half_map_2.map.gz emd_41583_half_map_2.map.gz | 200.4 MB 200.4 MB 10.5 MB 200.5 MB 200.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41583 http://ftp.pdbj.org/pub/emdb/structures/EMD-41583 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41583 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41583 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_41583_validation.pdf.gz emd_41583_validation.pdf.gz | 731.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_41583_full_validation.pdf.gz emd_41583_full_validation.pdf.gz | 730.8 KB | 表示 | |
| XML形式データ |  emd_41583_validation.xml.gz emd_41583_validation.xml.gz | 15.6 KB | 表示 | |
| CIF形式データ |  emd_41583_validation.cif.gz emd_41583_validation.cif.gz | 18.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41583 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41583 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41583 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41583 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8trmMC  8trnC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41583.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41583.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | T. gondii Act1; Density Modified Map from Helical Reconstruction | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.842 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: T. gondii Act1; Half Map from Local Refinement (3 protomer)
| ファイル | emd_41583_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
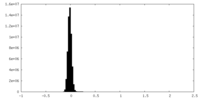
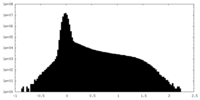
| 注釈 | T. gondii Act1; Half Map from Local Refinement (3 protomer) | ||||||||||||
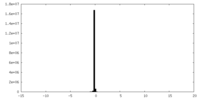
| 投影像・断面図 |
| ||||||||||||
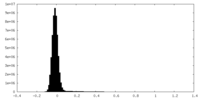
| 密度ヒストグラム |
-追加マップ: T. gondii Act1; Half Map from Local Refinement (3 protomer)
| ファイル | emd_41583_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
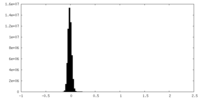
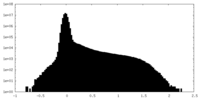
| 注釈 | T. gondii Act1; Half Map from Local Refinement (3 protomer) | ||||||||||||
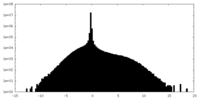
| 投影像・断面図 |
| ||||||||||||
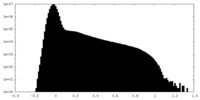
| 密度ヒストグラム |
-追加マップ: T. gondii Act1; Density Modified Map from Local...
| ファイル | emd_41583_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | T. gondii Act1; Density Modified Map from Local Refinement (3 protomer) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: T. gondii Act1; Half Map from Helical Reconstruction
| ファイル | emd_41583_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | T. gondii Act1; Half Map from Helical Reconstruction | ||||||||||||
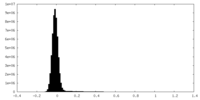
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: T. gondii Act1; Half Map from Helical Reconstruction
| ファイル | emd_41583_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | T. gondii Act1; Half Map from Helical Reconstruction | ||||||||||||
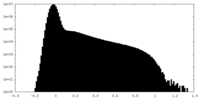
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Filament of Actin 1 from T. gondii with MgADP
| 全体 | 名称: Filament of Actin 1 from T. gondii with MgADP |
|---|---|
| 要素 |
|
-超分子 #1: Filament of Actin 1 from T. gondii with MgADP
| 超分子 | 名称: Filament of Actin 1 from T. gondii with MgADP / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: Actin protomers from T. gondii assemble into a two-start helix |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Actin
| 分子 | 名称: Actin / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 41.956711 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MADEEVQALV VDNGSGNVKA GVAGDDAPRA VFPSIVGKPK NPGIMVGMEE KDCYVGDEAQ SKRGILTLKY PIEHGIVTNW DDMEKIWHH TFYNELRVAP EEHPVLLTEA PLNPKANRER MTQIMFETFN VPAMYVAIQA VLSLYSSGRT TGIVLDSGDG V SHTVPIYE ...文字列: MADEEVQALV VDNGSGNVKA GVAGDDAPRA VFPSIVGKPK NPGIMVGMEE KDCYVGDEAQ SKRGILTLKY PIEHGIVTNW DDMEKIWHH TFYNELRVAP EEHPVLLTEA PLNPKANRER MTQIMFETFN VPAMYVAIQA VLSLYSSGRT TGIVLDSGDG V SHTVPIYE GYALPHAIMR LDLAGRDLTE YMMKILHERG YGFTTSAEKE IVRDIKEKLC YIALDFDEEM KAAEDSSDIE KS YELPDGN IITVGNERFR CPEALFQPSF LGKEAAGVHR TTFDSIMKCD VDIRKDLYGN VVLSGGTTMY EGIGERLTKE LTS LAPSTM KIKVVAPPER KYSVWIGGSI LSSLSTFQQM WITKEEYDES GPSIVHRKCF UniProtKB: Actin |
-分子 #2: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 2 / コピー数: 3 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 3 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 30 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.6 |
|---|---|
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / 装置: HOMEMADE PLUNGER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 検出モード: SUPER-RESOLUTION / 平均露光時間: 10.0 sec. / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.85 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 105000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 28.1 Å 想定した対称性 - らせんパラメータ - ΔΦ: -167 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 2.5 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: PHENIX (ver. 1.20) / 使用した粒子像数: 2248567 |
|---|---|
| 初期モデル | モデルのタイプ: NONE |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 4.2) |
-原子モデル構築 1
| 精密化 | プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-8trm: |
 ムービー
ムービー コントローラー
コントローラー








 Z
Z Y
Y X
X