+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human asparagine synthetase (apo-ASNS) | ||||||||||||||||||
 マップデータ マップデータ | Sharpened ASNS EM map | ||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||
 キーワード キーワード | asparagine / aspartic acid / glutamine / ammonia / BIOSYNTHETIC PROTEIN | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報asparagine synthase (glutamine-hydrolysing) / L-asparagine biosynthetic process / asparagine synthase (glutamine-hydrolyzing) activity / asparagine biosynthetic process / Response of EIF2AK1 (HRI) to heme deficiency / Aspartate and asparagine metabolism / ATF4 activates genes in response to endoplasmic reticulum stress / glutamine metabolic process / Response of EIF2AK4 (GCN2) to amino acid deficiency / cellular response to glucose starvation ...asparagine synthase (glutamine-hydrolysing) / L-asparagine biosynthetic process / asparagine synthase (glutamine-hydrolyzing) activity / asparagine biosynthetic process / Response of EIF2AK1 (HRI) to heme deficiency / Aspartate and asparagine metabolism / ATF4 activates genes in response to endoplasmic reticulum stress / glutamine metabolic process / Response of EIF2AK4 (GCN2) to amino acid deficiency / cellular response to glucose starvation / positive regulation of mitotic cell cycle / negative regulation of apoptotic process / ATP binding / cytosol 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||
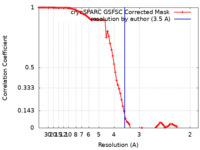
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Coricello A / Zhu W / Lupia A / Gratteri C / Vos M / Chaptal V / Alcaro S / Takagi Y / Richards N | ||||||||||||||||||
| 資金援助 |  米国, 米国,  フランス, フランス,  英国, European Union, 5件 英国, European Union, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Human asparagine synthetase (apo-ASNS) 著者: Takagi Y | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40764.map.gz emd_40764.map.gz | 54 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40764-v30.xml emd-40764-v30.xml emd-40764.xml emd-40764.xml | 15.9 KB 15.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_40764_fsc.xml emd_40764_fsc.xml | 8.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_40764.png emd_40764.png | 93.7 KB | ||
| Filedesc metadata |  emd-40764.cif.gz emd-40764.cif.gz | 6.1 KB | ||
| その他 |  emd_40764_half_map_1.map.gz emd_40764_half_map_1.map.gz emd_40764_half_map_2.map.gz emd_40764_half_map_2.map.gz | 59.3 MB 59.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40764 http://ftp.pdbj.org/pub/emdb/structures/EMD-40764 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40764 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40764 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_40764_validation.pdf.gz emd_40764_validation.pdf.gz | 815 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_40764_full_validation.pdf.gz emd_40764_full_validation.pdf.gz | 814.6 KB | 表示 | |
| XML形式データ |  emd_40764_validation.xml.gz emd_40764_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  emd_40764_validation.cif.gz emd_40764_validation.cif.gz | 20.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40764 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40764 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40764 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40764 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8sueMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40764.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40764.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened ASNS EM map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.93 Å | ||||||||||||||||||||||||||||||||||||
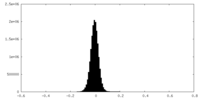
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: ASNS half map B
| ファイル | emd_40764_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | ASNS half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
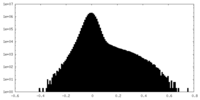
| 密度ヒストグラム |
-ハーフマップ: ASNS half map A
| ファイル | emd_40764_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | ASNS half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
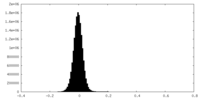
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human asparagine synthetase dimer form
| 全体 | 名称: human asparagine synthetase dimer form |
|---|---|
| 要素 |
|
-超分子 #1: human asparagine synthetase dimer form
| 超分子 | 名称: human asparagine synthetase dimer form / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 133 KDa |
-分子 #1: Asparagine synthetase [glutamine-hydrolyzing]
| 分子 | 名称: Asparagine synthetase [glutamine-hydrolyzing] / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: asparagine synthase (glutamine-hydrolysing) |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 64.324613 KDa |
| 組換発現 | 生物種: Insect cell expression vector pTIE1 (その他) |
| 配列 | 文字列: CGIWALFGSD DCLSVQCLSA MKIAHRGPDA FRFENVNGYT NCCFGFHRLA VVDPLFGMQP IRVKKYPYLW LCYNGEIYNH KKMQQHFEF EYQTKVDGEI ILHLYDKGGI EQTICMLDGV FAFVLLDTAN KKVFLGRDTY GVRPLFKAMT EDGFLAVCSE A KGLVTLKH ...文字列: CGIWALFGSD DCLSVQCLSA MKIAHRGPDA FRFENVNGYT NCCFGFHRLA VVDPLFGMQP IRVKKYPYLW LCYNGEIYNH KKMQQHFEF EYQTKVDGEI ILHLYDKGGI EQTICMLDGV FAFVLLDTAN KKVFLGRDTY GVRPLFKAMT EDGFLAVCSE A KGLVTLKH SATPFLKVEP FLPGHYEVLD LKPNGKVASV EMVKYHHCRD VPLHALYDNV EKLFPGFEIE TVKNNLRILF NN AVKKRLM TDRRIGCLLS GGLDSSLVAA TLLKQLKEAQ VQYPLQTFAI GMEDSPDLLA ARKVADHIGS EHYEVLFNSE EGI QALDEV IFSLETYDIT TVRASVGMYL ISKYIRKNTD SVVIFSGEGS DELTQGYIYF HKAPSPEKAE EESERLLREL YLFD VLRAD RTTAAHGLEL RVPFLDHRFS SYYLSLPPEM RIPKNGIEKH LLRETFEDSN LIPKEILWRP KEAFSDGITS VKNSW FKIL QEYVEHQVDD AMMANAAQKF PFNTPKTKEG YYYRQVFERH YPGRADWLSH YWMPKWINAT DPSARTLTHY KSAVKA UniProtKB: Asparagine synthetase [glutamine-hydrolyzing] |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 詳細: 25 mM Tris-HCl, pH 8.0, containing 250 mM NaCl and 5 mM DTT. |
|---|---|
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK IV |
| 詳細 | 9 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.4 µm |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)