[English] 日本語
 Yorodumi
Yorodumi- EMDB-30388: Structure of Machupo virus polymerase bound to Z matrix protein (... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: EMDB / ID: EMD-30388 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Structure of Machupo virus polymerase bound to Z matrix protein (monomeric complex) | |||||||||
 Map data Map data | ||||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | Machupo virus / Polymerase / Z protein / replication regulation / VIRAL PROTEIN | |||||||||
| Function / homology |  Function and homology information Function and homology informationnegative stranded viral RNA replication / viral budding via host ESCRT complex / cap snatching / viral budding from plasma membrane / virion component / host cell / Hydrolases; Acting on ester bonds / host cell cytoplasm / host cell perinuclear region of cytoplasm / hydrolase activity ...negative stranded viral RNA replication / viral budding via host ESCRT complex / cap snatching / viral budding from plasma membrane / virion component / host cell / Hydrolases; Acting on ester bonds / host cell cytoplasm / host cell perinuclear region of cytoplasm / hydrolase activity / RNA-directed RNA polymerase / nucleotide binding / RNA-directed RNA polymerase activity / host cell plasma membrane / RNA binding / zinc ion binding / metal ion binding / membrane Similarity search - Function | |||||||||
| Biological species |  Machupo mammarenavirus / Machupo mammarenavirus /  Machupo virus Machupo virus | |||||||||
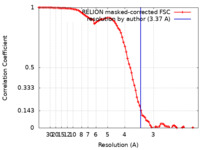
| Method | single particle reconstruction / cryo EM / Resolution: 3.37 Å | |||||||||
 Authors Authors | Xu X / Peng R | |||||||||
 Citation Citation |  Journal: Nat Microbiol / Year: 2021 Journal: Nat Microbiol / Year: 2021Title: Cryo-EM structures of Lassa and Machupo virus polymerases complexed with cognate regulatory Z proteins identify targets for antivirals. Authors: Xin Xu / Ruchao Peng / Qi Peng / Min Wang / Ying Xu / Sheng Liu / Xiaolin Tian / Haiteng Deng / Yimin Tong / Xiaoyou Hu / Jin Zhong / Peiyi Wang / Jianxun Qi / George F Gao / Yi Shi /  Abstract: Zoonotic arenaviruses can lead to life-threating diseases in humans. These viruses encode a large (L) polymerase that transcribes and replicates the viral genome. At the late stage of replication, ...Zoonotic arenaviruses can lead to life-threating diseases in humans. These viruses encode a large (L) polymerase that transcribes and replicates the viral genome. At the late stage of replication, the multifunctional Z protein interacts with the L polymerase to shut down RNA synthesis and initiate virion assembly. However, the mechanism by which the Z protein regulates the activity of L polymerase is unclear. Here, we used cryo-electron microscopy to resolve the structures of both Lassa and Machupo virus L polymerases in complex with their cognate Z proteins, and viral RNA, to 3.1-3.9 Å resolutions. These structures reveal that Z protein binding induces conformational changes in two catalytic motifs of the L polymerase, and restrains their conformational dynamics to inhibit RNA synthesis, which is supported by hydrogen-deuterium exchange mass spectrometry analysis. Importantly, we show, by in vitro polymerase reactions, that Z proteins of Lassa and Machupo viruses can cross-inhibit their L polymerases, albeit with decreased inhibition efficiencies. This cross-reactivity results from a highly conserved determinant motif at the contacting interface, but is affected by other variable auxiliary motifs due to the divergent evolution of Old World and New World arenaviruses. These findings could provide promising targets for developing broad-spectrum antiviral drugs. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | EM map:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| Supplemental images |
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_30388.map.gz emd_30388.map.gz | 2 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-30388-v30.xml emd-30388-v30.xml emd-30388.xml emd-30388.xml | 17.1 KB 17.1 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_30388_fsc.xml emd_30388_fsc.xml | 8.6 KB | Display |  FSC data file FSC data file |
| Images |  emd_30388.png emd_30388.png | 189 KB | ||
| Filedesc metadata |  emd-30388.cif.gz emd-30388.cif.gz | 7.4 KB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-30388 http://ftp.pdbj.org/pub/emdb/structures/EMD-30388 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30388 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30388 | HTTPS FTP |
-Related structure data
| Related structure data |  7ckmMC  7cklC  7el9C  7elaC  7elbC  7elcC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- Map
Map
| File |  Download / File: emd_30388.map.gz / Format: CCP4 / Size: 52.7 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_30388.map.gz / Format: CCP4 / Size: 52.7 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
CCP4 map header:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-Supplemental data
- Sample components
Sample components
-Entire : Machupo virus polymerase in complex with Z matrix protein
| Entire | Name: Machupo virus polymerase in complex with Z matrix protein |
|---|---|
| Components |
|
-Supramolecule #1: Machupo virus polymerase in complex with Z matrix protein
| Supramolecule | Name: Machupo virus polymerase in complex with Z matrix protein type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1-#2 |
|---|---|
| Source (natural) | Organism:  Machupo mammarenavirus Machupo mammarenavirus |
| Molecular weight | Theoretical: 260 KDa |
-Macromolecule #1: RNA-directed RNA polymerase L
| Macromolecule | Name: RNA-directed RNA polymerase L / type: protein_or_peptide / ID: 1 / Number of copies: 1 / Enantiomer: LEVO / EC number: RNA-directed RNA polymerase |
|---|---|
| Source (natural) | Organism:  Machupo virus Machupo virus |
| Molecular weight | Theoretical: 250.416062 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: MDEYVQELKG LIRKHIPERC EFGHQKVTFL SQVHPSPLLT EGFKLLSSLV ELESCEAHAC QANTDQRFVD VILSDNGILC PTLPKVIPD GFKLTGKTLI LLETFVRVNP DEFEKKWKAD MSKLLNLKHD LQKSGVTLVP IVDGRSNYNN RFVADWVIER I RWLLIEIL ...String: MDEYVQELKG LIRKHIPERC EFGHQKVTFL SQVHPSPLLT EGFKLLSSLV ELESCEAHAC QANTDQRFVD VILSDNGILC PTLPKVIPD GFKLTGKTLI LLETFVRVNP DEFEKKWKAD MSKLLNLKHD LQKSGVTLVP IVDGRSNYNN RFVADWVIER I RWLLIEIL KASKSMLEID IEDQEYQRLI HSLSNVKNQS LGLENLEHLK RNSLDYDERL NESLFIGLKG DIRESTVREE LI KLKLWFK DEVFSKGLGK FKLTDRRELL ESLSSLGAHL DSDVSSCPFC NNKLMEIVYN VTFSCVERTD GVATVDQQFS TTH SNIEKH YLSVLSLCNK IKGLKVFNTR RNTLLFLDLI MVNLMVDISD SCQDAIESLR KSGLIVGQMV MLVNDRVLDI LEAV KLIRK KIGTNPNWVK NCSKILERSH PEIWHHLSTL IKQPDFNSLI SIAQHLVSDR PIMRYSVERG SDKICRHKLF QEMSS FEQM RLFKTLSSIS LSLINSMKTS FSSRLLVNER EFSKYFGNVR LRECYAQRFY LAESLVGFLF YQKTGERSRC YSVYLS DNG VMSEQGSFYC DPKRFFLPVF SDEVLAGMCE EMTSWLDFDT GLMNDTGPIL RLLVLAILCS PSKRNQTFLQ GLRYFLM AF ANQIHHIDLT SKLVVECKSS SEVVVQRLAV GLFIRLLSGE SDASLFFSRR FKYLLNVSYL CHLITKETPD RLTDQIKC F EKFIEPKVKF GCAVVNPSLN GKLTVDQEDI MINGLKKFFS KSLRDTEDVQ TPGVCKELLN YCVSLFNRGK LKVSGELKN NPFRPNITST ALDLSSNKSV VIPKLDELGN ILSTYDKEKL VSACVSSMAE RFKTKGRYNL DPDSTDYLIL KNLTGLVSAG PKAKSTQEE LSLMYEALTE EQVESFNEIK HDVQVALAKM ADNSVNTRTK NLGRADNSVK NGNNPLDNLW SPFGVMKEIR A EVSLHEVK DFDPDVLPPE VYKELCDAVY KSSEKCNFFL EGVLDVCPLG LLLKNLTTSS YVDEEYFMCF KYLLIQGHFD QK LGSYEHK SRSRLGFTDE TLRLKDEVRL SIRESNSEAI ADKLDKSYFT NAALRNLCFY SEDSPTEFTS ISSNSGNLKF GLS YKEQVG SNRELYVGDL NTKLMTRLVE DFSEAVGNSM KYTCLNSEKE FERAICDMKM AVNNGDLSCS YDHSKWGPTM SPAL FLALL QMLELRTPVD RSKIDLDSVK SILKWHLHKV VEVPINVAEA YCIGKLKRSL GLMGCGSTSL SEEFFHQTMQ LNGQI PSHI MSVLDMGQGI LHNTSDLYGL ITEQFLCYAL DLLYDVIPVS YTSSDDQITL IKTPSLDIEG GSDAAEWLEM ICFHEF LSS KLNKFVSPKS VIGTFVAEFK SRFFVMGEET PLLTKFVAAA LHNVKCKTPT QLSETIDTIC DQCIANGVST KIVTRIS KR VNQLIRYSGY GETPFGAIED QDVKDWVDGS RGYRLQRKIE AIFHDDKETS FIRNCARKVF NDIKRGRIFE ENLINLIG R GGDEALTGFL QYAGCSEQEV NRVLNYRWVN LSSFGDLRLV LRTKLMTSRR VLEREEVPTL IKTLQSKLSR NFTKGVKKI LAESINKSAF QSSVASGFIG FCKSMGSKCV RDGKGGFLYI KEVYSGVSAC TCEICALKPK IIYCNNSLNK VSQFSKPILW DYFSLVLTN ACELGEWVFS TVKEPQKPLV LNNQNFFWAV KPKVVRQIED QLGMNHVLQS IRRNYPVLFD EHLTPFMNDL Q VSRTMDSG RLKFLDVCIA LDMMNENLGI ISHLLKTRDN SVYIVKQSDC ALAHIRQSSY TDWELGLSPQ QICTNFKTQL VL SSMVNPL VLSTSCLKSF FWFNEVLELE DDSQIELAEL TDFALMVKNQ NVSRAMFVED IAMGYVVSNF EGVRISLSNV MVD GVQLPP QEKAPDIGEL FGLKAENVIV GLVVQIDHVR MSTKFKLKRK MVYSFSLECI MDVGEIQNKE VILKVVAVDQ SVSG SGGNH MLLDGVSVVA SLPLFTGQAS FDLAAMLIES NLAGSNDNFL MRNVTLDLGG FSPELSDKYS YRLSGPENQE DPLVL KDGA FYVGGERLST YKVEFTGDLV VKALGALEDD ESVVSMLHQL WPYLKATSQV ILFQQEDFTI VHDLYKKQLT KSIESF GEW IEFTNFKVAY SKSLKELVIS DTQGSFRLKG VMCRPLASTP QVEDIE UniProtKB: RNA-directed RNA polymerase L |
-Macromolecule #2: RING finger protein Z
| Macromolecule | Name: RING finger protein Z / type: protein_or_peptide / ID: 2 / Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Machupo virus Machupo virus |
| Molecular weight | Theoretical: 10.660265 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: MGNCNKPPKR PPNTQTSSNQ PSAEFRRTAP PSLYGRYNCK CCWFADTNLI TCNDHYLCLR CHQTMLRNSE LCHICWKPLP TSITVPVEP SAPPP UniProtKB: RING finger protein Z |
-Macromolecule #3: MANGANESE (II) ION
| Macromolecule | Name: MANGANESE (II) ION / type: ligand / ID: 3 / Number of copies: 1 / Formula: MN |
|---|---|
| Molecular weight | Theoretical: 54.938 Da |
-Macromolecule #4: ZINC ION
| Macromolecule | Name: ZINC ION / type: ligand / ID: 4 / Number of copies: 4 / Formula: ZN |
|---|---|
| Molecular weight | Theoretical: 65.409 Da |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 1 mg/mL |
|---|---|
| Buffer | pH: 7.5 |
| Grid | Model: Quantifoil R1.2/1.3 / Material: COPPER / Mesh: 300 / Support film - Material: CARBON / Support film - topology: HOLEY / Pretreatment - Type: GLOW DISCHARGE / Pretreatment - Time: 60 sec. / Pretreatment - Atmosphere: AIR |
| Vitrification | Cryogen name: ETHANE / Chamber humidity: 100 % / Chamber temperature: 277 K / Instrument: FEI VITROBOT MARK IV |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Specialist optics | Energy filter - Name: GIF Bioquantum / Energy filter - Slit width: 20 eV |
| Image recording | Film or detector model: GATAN K2 SUMMIT (4k x 4k) / Detector mode: SUPER-RESOLUTION / Digitization - Frames/image: 3-17 / Average electron dose: 60.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm |
| Sample stage | Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER / Cooling holder cryogen: NITROGEN |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Initial model |
| ||||||
|---|---|---|---|---|---|---|---|
| Refinement | Space: REAL / Protocol: FLEXIBLE FIT / Target criteria: Correlation coefficient | ||||||
| Output model |  PDB-7ckm: |
 Movie
Movie Controller
Controller


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)