+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Interaction of H3 tail in LIN28B nucleosome with Oct4 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Oct4 / Nucleosome / Pioneer factor / LIN28B DNA / iPSc / DNA BINDING PROTEIN-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cell fate commitment involved in formation of primary germ layer / cardiac cell fate determination / POU5F1 (OCT4), SOX2, NANOG repress genes related to differentiation / Formation of the anterior neural plate / endodermal-mesodermal cell signaling / regulation of asymmetric cell division / endodermal cell fate specification / heart induction / Specification of primordial germ cells / POU5F1 (OCT4), SOX2, NANOG activate genes related to proliferation ...cell fate commitment involved in formation of primary germ layer / cardiac cell fate determination / POU5F1 (OCT4), SOX2, NANOG repress genes related to differentiation / Formation of the anterior neural plate / endodermal-mesodermal cell signaling / regulation of asymmetric cell division / endodermal cell fate specification / heart induction / Specification of primordial germ cells / POU5F1 (OCT4), SOX2, NANOG activate genes related to proliferation / Specification of the neural plate border / Transcriptional regulation of pluripotent stem cells / Germ layer formation at gastrulation / miRNA binding / somatic stem cell population maintenance / blastocyst development / anatomical structure morphogenesis / BMP signaling pathway / negative regulation of miRNA transcription / response to wounding / DNA-binding transcription repressor activity, RNA polymerase II-specific / sequence-specific double-stranded DNA binding / structural constituent of chromatin / positive regulation of canonical Wnt signaling pathway / nucleosome / heterochromatin formation / nucleosome assembly / regulation of gene expression / transcription regulator complex / RNA polymerase II-specific DNA-binding transcription factor binding / sequence-specific DNA binding / DNA-binding transcription factor activity, RNA polymerase II-specific / transcription cis-regulatory region binding / RNA polymerase II cis-regulatory region sequence-specific DNA binding / protein heterodimerization activity / DNA-binding transcription factor activity / ubiquitin protein ligase binding / regulation of DNA-templated transcription / regulation of transcription by RNA polymerase II / negative regulation of transcription by RNA polymerase II / positive regulation of transcription by RNA polymerase II / mitochondrion / DNA binding / RNA binding / nucleoplasm / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Sinha KK / Bilokapic S / Du Y / Malik D / Halic M | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Histone modifications regulate pioneer transcription factor cooperativity. 著者: Kalyan K Sinha / Silvija Bilokapic / Yongming Du / Deepshikha Malik / Mario Halic /  要旨: Pioneer transcription factors have the ability to access DNA in compacted chromatin. Multiple transcription factors can bind together to a regulatory element in a cooperative way, and cooperation ...Pioneer transcription factors have the ability to access DNA in compacted chromatin. Multiple transcription factors can bind together to a regulatory element in a cooperative way, and cooperation between the pioneer transcription factors OCT4 (also known as POU5F1) and SOX2 is important for pluripotency and reprogramming. However, the molecular mechanisms by which pioneer transcription factors function and cooperate on chromatin remain unclear. Here we present cryo-electron microscopy structures of human OCT4 bound to a nucleosome containing human LIN28B or nMATN1 DNA sequences, both of which bear multiple binding sites for OCT4. Our structural and biochemistry data reveal that binding of OCT4 induces changes to the nucleosome structure, repositions the nucleosomal DNA and facilitates cooperative binding of additional OCT4 and of SOX2 to their internal binding sites. The flexible activation domain of OCT4 contacts the N-terminal tail of histone H4, altering its conformation and thus promoting chromatin decompaction. Moreover, the DNA-binding domain of OCT4 engages with the N-terminal tail of histone H3, and post-translational modifications at H3K27 modulate DNA positioning and affect transcription factor cooperativity. Thus, our findings suggest that the epigenetic landscape could regulate OCT4 activity to ensure proper cell programming. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29850.map.gz emd_29850.map.gz | 40.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29850-v30.xml emd-29850-v30.xml emd-29850.xml emd-29850.xml | 24.3 KB 24.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_29850.png emd_29850.png | 67.9 KB | ||
| Filedesc metadata |  emd-29850.cif.gz emd-29850.cif.gz | 6.9 KB | ||
| その他 |  emd_29850_half_map_1.map.gz emd_29850_half_map_1.map.gz emd_29850_half_map_2.map.gz emd_29850_half_map_2.map.gz | 40.8 MB 40.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29850 http://ftp.pdbj.org/pub/emdb/structures/EMD-29850 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29850 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29850 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29850_validation.pdf.gz emd_29850_validation.pdf.gz | 808.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29850_full_validation.pdf.gz emd_29850_full_validation.pdf.gz | 808.1 KB | 表示 | |
| XML形式データ |  emd_29850_validation.xml.gz emd_29850_validation.xml.gz | 11.8 KB | 表示 | |
| CIF形式データ |  emd_29850_validation.cif.gz emd_29850_validation.cif.gz | 13.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29850 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29850 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29850 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29850 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29850.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29850.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||
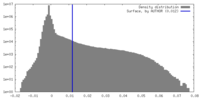
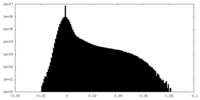
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_29850_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
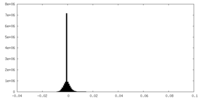
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_29850_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
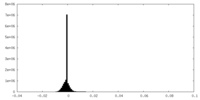
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Nucleosome with Human LIN28B sequence bound to human Oct4
| 全体 | 名称: Nucleosome with Human LIN28B sequence bound to human Oct4 |
|---|---|
| 要素 |
|
-超分子 #1: Nucleosome with Human LIN28B sequence bound to human Oct4
| 超分子 | 名称: Nucleosome with Human LIN28B sequence bound to human Oct4 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#7 |
|---|---|
| 由来(天然) | 生物種: |
-分子 #1: Histone H3
| 分子 | 名称: Histone H3 / タイプ: protein_or_peptide / ID: 1 / 詳細: Histone H3.2|Xenopus laevis / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 15.30393 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: ARTKQTARKS TGGKAPRKQL ATKAARKSAP ATGGVKKPHR YRPGTVALRE IRRYQKSTEL LIRKLPFQRL VREIAQDFKT DLRFQSSAV MALQEASEAY LVALFEDTNL CAIHAKRVTI MPKDIQLARR IRGERA UniProtKB: Histone H3.2 |
-分子 #2: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 2 / 詳細: Histone H4|Xenopus laevis / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 11.263231 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SGRGKGGKGL GKGGAKRHRK VLRDNIQGIT KPAIRRLARR GGVKRISGLI YEETRGVLKV FLENVIRDAV TYTEHAKRKT VTAMDVVYA LKRQGRTLYG FGG UniProtKB: Histone H4 |
-分子 #3: Histone H2A
| 分子 | 名称: Histone H2A / タイプ: protein_or_peptide / ID: 3 / 詳細: Histone H2A|Xenopus laevis / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 13.978241 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SGRGKQGGKT RAKAKTRSSR AGLQFPVGRV HRLLRKGNYA ERVGAGAPVY LAAVLEYLTA EILELAGNAA RDNKKTRIIP RHLQLAVRN DEELNKLLGR VTIAQGGVLP NIQSVLLPKK TESSKSAKSK UniProtKB: Histone H2A |
-分子 #4: Histone H2B
| 分子 | 名称: Histone H2B / タイプ: protein_or_peptide / ID: 4 / 詳細: Histone H2B 1.1|Xenopus laevis / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 13.524752 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: AKSAPAPKKG SKKAVTKTQK KDGKKRRKTR KESYAIYVYK VLKQVHPDTG ISSKAMSIMN SFVNDVFERI AGEASRLAHY NKRSTITSR EIQTAVRLLL PGELAKHAVS EGTKAVTKYT SAK UniProtKB: Histone H2B 1.1 |
-分子 #7: POU domain, class 5, transcription factor 1
| 分子 | 名称: POU domain, class 5, transcription factor 1 / タイプ: protein_or_peptide / ID: 7 / 詳細: Human Oct4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 42.299453 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSSHHHHHHS SGLVPRGSHM ASMTGGQQMG RDPNSMAGHL ASDFAFSPPP GGGGDGPGGP EPGWVDPRTW LSFQGPPGGP GIGPGVGPG SEVWGIPPCP PPYEFCGGMA YCGPQVGVGL VPQGGLETSQ PEGEAGVGVE SNSDGASPEP CTVTPGAVKL E KEKLEQNP ...文字列: GSSHHHHHHS SGLVPRGSHM ASMTGGQQMG RDPNSMAGHL ASDFAFSPPP GGGGDGPGGP EPGWVDPRTW LSFQGPPGGP GIGPGVGPG SEVWGIPPCP PPYEFCGGMA YCGPQVGVGL VPQGGLETSQ PEGEAGVGVE SNSDGASPEP CTVTPGAVKL E KEKLEQNP EESQDIKALQ KELEQFAKLL KQKRITLGYT QADVGLTLGV LFGKVFSQTT ICRFEALQLS FKNMCKLRPL LQ KWVEEAD NNENLQEICK AETLVQARKR KRTSIENRVR GNLENLFLQC PKPTLQQISH IAQQLGLEKD VVRVWFCNRR QKG KRSSSD YAQREDFEAA GSPFSGGPVS FPLAPGPHFG TPGYGSPHFT ALYSSVPFPE GEAFPPVSVT TLGSPMHSN UniProtKB: POU domain, class 5, transcription factor 1 |
-分子 #5: LIN28B DNA (174-MER)
| 分子 | 名称: LIN28B DNA (174-MER) / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 55.827664 KDa |
| 配列 | 文字列: (DA)(DT)(DG)(DA)(DA)(DG)(DT)(DA)(DT)(DG) (DT)(DG)(DT)(DC)(DT)(DT)(DT)(DA)(DT)(DT) (DC)(DA)(DC)(DA)(DA)(DG)(DC)(DT)(DT) (DG)(DC)(DA)(DC)(DA)(DA)(DT)(DC)(DC)(DC) (DT) (DG)(DC)(DT)(DG)(DG) ...文字列: (DA)(DT)(DG)(DA)(DA)(DG)(DT)(DA)(DT)(DG) (DT)(DG)(DT)(DC)(DT)(DT)(DT)(DA)(DT)(DT) (DC)(DA)(DC)(DA)(DA)(DG)(DC)(DT)(DT) (DG)(DC)(DA)(DC)(DA)(DA)(DT)(DC)(DC)(DC) (DT) (DG)(DC)(DT)(DG)(DG)(DA)(DC)(DA) (DA)(DT)(DT)(DC)(DT)(DG)(DA)(DG)(DT)(DG) (DA)(DT) (DG)(DG)(DC)(DA)(DG)(DC)(DT) (DC)(DC)(DC)(DA)(DC)(DC)(DT)(DT)(DT)(DC) (DC)(DT)(DT) (DC)(DT)(DT)(DT)(DC)(DT) (DT)(DC)(DA)(DC)(DT)(DT)(DA)(DG)(DA)(DC) (DT)(DA)(DC)(DA) (DT)(DT)(DT)(DA)(DT) (DT)(DC)(DA)(DG)(DC)(DA)(DT)(DC)(DT)(DG) (DT)(DA)(DT)(DT)(DG) (DT)(DT)(DG)(DG) (DA)(DG)(DT)(DA)(DA)(DG)(DT)(DT)(DC)(DC) (DA)(DT)(DG)(DT)(DT)(DA) (DA)(DT)(DA) (DC)(DT)(DC)(DA)(DC)(DC)(DA)(DC)(DT)(DG) (DA)(DG)(DG)(DA)(DT)(DA)(DT) (DG)(DT) (DT)(DA)(DA)(DT)(DA)(DC)(DC)(DA)(DC)(DT) (DT)(DA)(DA)(DC)(DT)(DT)(DA)(DT) (DG) (DC) |
-分子 #6: LIN28B DNA (174-MER)
| 分子 | 名称: LIN28B DNA (174-MER) / タイプ: dna / ID: 6 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 56.519281 KDa |
| 配列 | 文字列: (DG)(DC)(DA)(DT)(DA)(DA)(DG)(DT)(DT)(DA) (DA)(DG)(DT)(DG)(DG)(DT)(DA)(DT)(DT)(DA) (DA)(DC)(DA)(DT)(DA)(DT)(DC)(DC)(DT) (DC)(DA)(DG)(DT)(DG)(DG)(DT)(DG)(DA)(DG) (DT) (DA)(DT)(DT)(DA)(DA) ...文字列: (DG)(DC)(DA)(DT)(DA)(DA)(DG)(DT)(DT)(DA) (DA)(DG)(DT)(DG)(DG)(DT)(DA)(DT)(DT)(DA) (DA)(DC)(DA)(DT)(DA)(DT)(DC)(DC)(DT) (DC)(DA)(DG)(DT)(DG)(DG)(DT)(DG)(DA)(DG) (DT) (DA)(DT)(DT)(DA)(DA)(DC)(DA)(DT) (DG)(DG)(DA)(DA)(DC)(DT)(DT)(DA)(DC)(DT) (DC)(DC) (DA)(DA)(DC)(DA)(DA)(DT)(DA) (DC)(DA)(DG)(DA)(DT)(DG)(DC)(DT)(DG)(DA) (DA)(DT)(DA) (DA)(DA)(DT)(DG)(DT)(DA) (DG)(DT)(DC)(DT)(DA)(DA)(DG)(DT)(DG)(DA) (DA)(DG)(DA)(DA) (DA)(DG)(DA)(DA)(DG) (DG)(DA)(DA)(DA)(DG)(DG)(DT)(DG)(DG)(DG) (DA)(DG)(DC)(DT)(DG) (DC)(DC)(DA)(DT) (DC)(DA)(DC)(DT)(DC)(DA)(DG)(DA)(DA)(DT) (DT)(DG)(DT)(DC)(DC)(DA) (DG)(DC)(DA) (DG)(DG)(DG)(DA)(DT)(DT)(DG)(DT)(DG)(DC) (DA)(DA)(DG)(DC)(DT)(DT)(DG) (DT)(DG) (DA)(DA)(DT)(DA)(DA)(DA)(DG)(DA)(DC)(DA) (DC)(DA)(DT)(DA)(DC)(DT)(DT)(DC) (DA) (DT) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.25 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: 50 mM HEPES pH 7.5, 1 mM DTT | |||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 90.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: EMDB MAP EMDB ID: |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 53000 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)