+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | H2BK120ub+H3K79me2-modified nucleosome ubiquitin position 5 | |||||||||
 マップデータ マップデータ | Sharpened Map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | nucleosome / ubiquitin / histone / chromatin / DNA BINDING PROTEIN / DNA BINDING PROTEIN-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報hypothalamus gonadotrophin-releasing hormone neuron development / female meiosis I / positive regulation of protein monoubiquitination / fat pad development / mitochondrion transport along microtubule / female gonad development / seminiferous tubule development / male meiosis I / positive regulation of intrinsic apoptotic signaling pathway by p53 class mediator / energy homeostasis ...hypothalamus gonadotrophin-releasing hormone neuron development / female meiosis I / positive regulation of protein monoubiquitination / fat pad development / mitochondrion transport along microtubule / female gonad development / seminiferous tubule development / male meiosis I / positive regulation of intrinsic apoptotic signaling pathway by p53 class mediator / energy homeostasis / regulation of neuron apoptotic process / regulation of proteasomal protein catabolic process / Maturation of protein E / Maturation of protein E / ER Quality Control Compartment (ERQC) / Myoclonic epilepsy of Lafora / FLT3 signaling by CBL mutants / Prevention of phagosomal-lysosomal fusion / IRAK2 mediated activation of TAK1 complex / Alpha-protein kinase 1 signaling pathway / Glycogen synthesis / IRAK1 recruits IKK complex / IRAK1 recruits IKK complex upon TLR7/8 or 9 stimulation / Membrane binding and targetting of GAG proteins / Endosomal Sorting Complex Required For Transport (ESCRT) / Regulation of TBK1, IKKε (IKBKE)-mediated activation of IRF3, IRF7 / Negative regulation of FLT3 / PTK6 Regulates RTKs and Their Effectors AKT1 and DOK1 / Regulation of TBK1, IKKε-mediated activation of IRF3, IRF7 upon TLR3 ligation / Constitutive Signaling by NOTCH1 HD Domain Mutants / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / NOTCH2 Activation and Transmission of Signal to the Nucleus / TICAM1,TRAF6-dependent induction of TAK1 complex / TICAM1-dependent activation of IRF3/IRF7 / APC/C:Cdc20 mediated degradation of Cyclin B / Regulation of FZD by ubiquitination / Downregulation of ERBB4 signaling / APC-Cdc20 mediated degradation of Nek2A / p75NTR recruits signalling complexes / InlA-mediated entry of Listeria monocytogenes into host cells / TRAF6 mediated IRF7 activation in TLR7/8 or 9 signaling / TRAF6-mediated induction of TAK1 complex within TLR4 complex / Regulation of pyruvate metabolism / Regulation of innate immune responses to cytosolic DNA / NF-kB is activated and signals survival / Downregulation of ERBB2:ERBB3 signaling / Pexophagy / NRIF signals cell death from the nucleus / VLDLR internalisation and degradation / Regulation of PTEN localization / Activated NOTCH1 Transmits Signal to the Nucleus / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / Regulation of BACH1 activity / MAP3K8 (TPL2)-dependent MAPK1/3 activation / TICAM1, RIP1-mediated IKK complex recruitment / Translesion synthesis by REV1 / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / Translesion synthesis by POLK / InlB-mediated entry of Listeria monocytogenes into host cell / Downregulation of TGF-beta receptor signaling / Josephin domain DUBs / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / Regulation of activated PAK-2p34 by proteasome mediated degradation / Translesion synthesis by POLI / IKK complex recruitment mediated by RIP1 / Gap-filling DNA repair synthesis and ligation in GG-NER / positive regulation of protein ubiquitination / neuron projection morphogenesis / PINK1-PRKN Mediated Mitophagy / regulation of mitochondrial membrane potential / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) / TNFR1-induced NF-kappa-B signaling pathway / Autodegradation of Cdh1 by Cdh1:APC/C / APC/C:Cdc20 mediated degradation of Securin / N-glycan trimming in the ER and Calnexin/Calreticulin cycle / TCF dependent signaling in response to WNT / Asymmetric localization of PCP proteins / Regulation of NF-kappa B signaling / Ubiquitin-dependent degradation of Cyclin D / SCF-beta-TrCP mediated degradation of Emi1 / NIK-->noncanonical NF-kB signaling / activated TAK1 mediates p38 MAPK activation / Negative regulators of DDX58/IFIH1 signaling / TNFR2 non-canonical NF-kB pathway / AUF1 (hnRNP D0) binds and destabilizes mRNA / Regulation of signaling by CBL / NOTCH3 Activation and Transmission of Signal to the Nucleus / Vpu mediated degradation of CD4 / Assembly of the pre-replicative complex / Ubiquitin-Mediated Degradation of Phosphorylated Cdc25A / Degradation of DVL / Deactivation of the beta-catenin transactivating complex / Negative regulation of FGFR3 signaling / Cdc20:Phospho-APC/C mediated degradation of Cyclin A / Dectin-1 mediated noncanonical NF-kB signaling / Fanconi Anemia Pathway / Peroxisomal protein import / Negative regulation of FGFR2 signaling / Negative regulation of FGFR4 signaling / Regulation of TNFR1 signaling 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
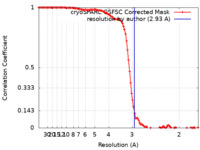
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.93 Å | |||||||||
 データ登録者 データ登録者 | Hicks CW / Wolberger C / Keogh M | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2024 ジャーナル: Nucleic Acids Res / 年: 2024タイトル: Ubiquitinated histone H2B as gatekeeper of the nucleosome acidic patch. 著者: Chad W Hicks / Sanim Rahman / Susan L Gloor / James K Fields / Natalia Ledo Husby / Anup Vaidya / Keith E Maier / Michael Morgan / Michael-Christopher Keogh / Cynthia Wolberger /  要旨: Monoubiquitination of histones H2B-K120 (H2BK120ub) and H2A-K119 (H2AK119ub) play opposing roles in regulating transcription and chromatin compaction. H2BK120ub is a hallmark of actively transcribed ...Monoubiquitination of histones H2B-K120 (H2BK120ub) and H2A-K119 (H2AK119ub) play opposing roles in regulating transcription and chromatin compaction. H2BK120ub is a hallmark of actively transcribed euchromatin, while H2AK119ub is highly enriched in transcriptionally repressed heterochromatin. Whereas H2BK120ub is known to stimulate the binding or activity of various chromatin-modifying enzymes, this post-translational modification (PTM) also interferes with the binding of several proteins to the nucleosome H2A/H2B acidic patch via an unknown mechanism. Here, we report cryoEM structures of an H2BK120ub nucleosome showing that ubiquitin adopts discrete positions that occlude the acidic patch. Molecular dynamics simulations show that ubiquitin remains stably positioned over this nucleosome region. By contrast, our cryoEM structures of H2AK119ub nucleosomes show ubiquitin adopting discrete positions that minimally occlude the acidic patch. Consistent with these observations, H2BK120ub, but not H2AK119ub, abrogates nucleosome interactions with acidic patch-binding proteins RCC1 and LANA, and single-domain antibodies specific to this region. Our results suggest a mechanism by which H2BK120ub serves as a gatekeeper to the acidic patch and point to distinct roles for histone H2AK119 and H2BK120 ubiquitination in regulating protein binding to nucleosomes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29767.map.gz emd_29767.map.gz | 3.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29767-v30.xml emd-29767-v30.xml emd-29767.xml emd-29767.xml | 25.5 KB 25.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29767_fsc.xml emd_29767_fsc.xml | 10.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29767.png emd_29767.png | 154 KB | ||
| マスクデータ |  emd_29767_msk_1.map emd_29767_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-29767.cif.gz emd-29767.cif.gz | 6.6 KB | ||
| その他 |  emd_29767_additional_1.map.gz emd_29767_additional_1.map.gz emd_29767_half_map_1.map.gz emd_29767_half_map_1.map.gz emd_29767_half_map_2.map.gz emd_29767_half_map_2.map.gz | 62.9 MB 116.1 MB 116.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29767 http://ftp.pdbj.org/pub/emdb/structures/EMD-29767 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29767 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29767 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29767_validation.pdf.gz emd_29767_validation.pdf.gz | 855.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29767_full_validation.pdf.gz emd_29767_full_validation.pdf.gz | 854.7 KB | 表示 | |
| XML形式データ |  emd_29767_validation.xml.gz emd_29767_validation.xml.gz | 19.2 KB | 表示 | |
| CIF形式データ |  emd_29767_validation.cif.gz emd_29767_validation.cif.gz | 24.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29767 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29767 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29767 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29767 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8g6gMC  8g6hC  8g6qC  8g6sC  8v25C  8v26C  8v27C  8v28C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29767.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29767.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened Map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.872 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29767_msk_1.map emd_29767_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
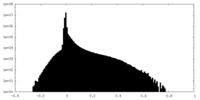
| 密度ヒストグラム |
-追加マップ: Unsharpened Map
| ファイル | emd_29767_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened Map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
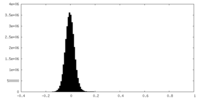
| 密度ヒストグラム |
-ハーフマップ: Half Map B
| ファイル | emd_29767_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
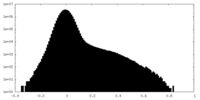
| 密度ヒストグラム |
-ハーフマップ: Half Map A
| ファイル | emd_29767_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
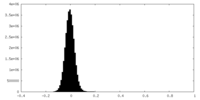
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : H2BK120ub+H3K79me2-modified nucleosome
| 全体 | 名称: H2BK120ub+H3K79me2-modified nucleosome |
|---|---|
| 要素 |
|
-超分子 #1: H2BK120ub+H3K79me2-modified nucleosome
| 超分子 | 名称: H2BK120ub+H3K79me2-modified nucleosome / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#7 |
|---|---|
| 由来(天然) | 生物種: |
-分子 #1: Histone H3
| 分子 | 名称: Histone H3 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 15.430106 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MARTKQTARK STGGKAPRKQ LATKAARKSA PATGGVKKPH RYRPGTVALR EIRRYQKSTE LLIRKLPFQR LVREIAQDF (MLY)TDLRFQSSA VMALQEASEA YLVALFEDTN LAAIHAKRVT IMPKDIQLAR RIRGERA UniProtKB: Histone H3 |
-分子 #2: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 11.394426 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSGRGKGGKG LGKGGAKRHR KVLRDNIQGI TKPAIRRLAR RGGVKRISGL IYEETRGVLK VFLENVIRDA VTYTEHAKRK TVTAMDVVY ALKRQGRTLY GFGG UniProtKB: Histone H4 |
-分子 #3: Histone H2A
| 分子 | 名称: Histone H2A / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 14.109436 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSGRGKQGGK TRAKAKTRSS RAGLQFPVGR VHRLLRKGNY AERVGAGAPV YLAAVLEYLT AEILELAGNA ARDNKKTRII PRHLQLAVR NDEELNKLLG RVTIAQGGVL PNIQSVLLPK KTESSKSAKS K UniProtKB: Histone H2A |
-分子 #4: Histone H2B 1.1
| 分子 | 名称: Histone H2B 1.1 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 13.629911 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAKSAPAPKK GSKKAVTKTQ KKDGKKRRKT RKESYAIYVY KVLKQVHPDT GISSKAMSIM NSFVNDVFER IAGEASRLAH YNKRSTITS REIQTAVRLL LPGELAKHAV SEGTKAVTCY TSAK UniProtKB: Histone H2B 1.1 |
-分子 #7: Ubiquitin
| 分子 | 名称: Ubiquitin / タイプ: protein_or_peptide / ID: 7 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 9.036393 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMMQIFVK TLTGKTITLE VEPSDTIENV KAKIQDKEGI PPDQQRLIFA GKQLEDGRTL SDYNIQKEST LHLVLRLRGC UniProtKB: Polyubiquitin-B |
-分子 #5: 601 DNA (185-MER)
| 分子 | 名称: 601 DNA (185-MER) / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 56.79616 KDa |
| 配列 | 文字列: (DG)(DA)(DC)(DC)(DC)(DT)(DA)(DT)(DA)(DC) (DG)(DC)(DG)(DG)(DC)(DC)(DG)(DC)(DC)(DC) (DA)(DT)(DC)(DA)(DG)(DA)(DA)(DT)(DC) (DC)(DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA) (DG) (DG)(DC)(DC)(DG)(DC) ...文字列: (DG)(DA)(DC)(DC)(DC)(DT)(DA)(DT)(DA)(DC) (DG)(DC)(DG)(DG)(DC)(DC)(DG)(DC)(DC)(DC) (DA)(DT)(DC)(DA)(DG)(DA)(DA)(DT)(DC) (DC)(DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA) (DG) (DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA) (DA)(DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA) (DG)(DA) (DC)(DA)(DG)(DC)(DT)(DC)(DT) (DA)(DG)(DC)(DA)(DC)(DC)(DG)(DC)(DT)(DT) (DA)(DA)(DA) (DC)(DG)(DC)(DA)(DC)(DG) (DT)(DA)(DC)(DG)(DC)(DG)(DC)(DT)(DG)(DT) (DC)(DC)(DC)(DC) (DC)(DG)(DC)(DG)(DT) (DT)(DT)(DT)(DA)(DA)(DC)(DC)(DG)(DC)(DC) (DA)(DA)(DG)(DG)(DG) (DG)(DA)(DT)(DT) (DA)(DC)(DT)(DC)(DC)(DC)(DT)(DA)(DG)(DT) (DC)(DT)(DC)(DC)(DA)(DG) (DG)(DC)(DA) (DC)(DG)(DT)(DG)(DT)(DC)(DA)(DG)(DA)(DT) (DA)(DT)(DA)(DT)(DA)(DC)(DA) (DT)(DC) (DG)(DA)(DT)(DT)(DG)(DC)(DC)(DG)(DG)(DT) (DC)(DG)(DC)(DG)(DA)(DA)(DC)(DA) (DG) (DC)(DG)(DA)(DC) |
-分子 #6: 601 DNA (185-MER)
| 分子 | 名称: 601 DNA (185-MER) / タイプ: dna / ID: 6 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 57.440531 KDa |
| 配列 | 文字列: (DG)(DT)(DC)(DG)(DC)(DT)(DG)(DT)(DT)(DC) (DG)(DC)(DG)(DA)(DC)(DC)(DG)(DG)(DC)(DA) (DA)(DT)(DC)(DG)(DA)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC) (DA) (DC)(DG)(DT)(DG)(DC) ...文字列: (DG)(DT)(DC)(DG)(DC)(DT)(DG)(DT)(DT)(DC) (DG)(DC)(DG)(DA)(DC)(DC)(DG)(DG)(DC)(DA) (DA)(DT)(DC)(DG)(DA)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC) (DA) (DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG) (DG)(DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG) (DA)(DG) (DT)(DA)(DA)(DT)(DC)(DC)(DC) (DC)(DT)(DT)(DG)(DG)(DC)(DG)(DG)(DT)(DT) (DA)(DA)(DA) (DA)(DC)(DG)(DC)(DG)(DG) (DG)(DG)(DG)(DA)(DC)(DA)(DG)(DC)(DG)(DC) (DG)(DT)(DA)(DC) (DG)(DT)(DG)(DC)(DG) (DT)(DT)(DT)(DA)(DA)(DG)(DC)(DG)(DG)(DT) (DG)(DC)(DT)(DA)(DG) (DA)(DG)(DC)(DT) (DG)(DT)(DC)(DT)(DA)(DC)(DG)(DA)(DC)(DC) (DA)(DA)(DT)(DT)(DG)(DA) (DG)(DC)(DG) (DG)(DC)(DC)(DT)(DC)(DG)(DG)(DC)(DA)(DC) (DC)(DG)(DG)(DG)(DA)(DT)(DT) (DC)(DT) (DG)(DA)(DT)(DG)(DG)(DG)(DC)(DG)(DG)(DC) (DC)(DG)(DC)(DG)(DT)(DA)(DT)(DA) (DG) (DG)(DG)(DT)(DC) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.75 µm / 最小 デフォーカス(公称値): 0.75 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)