+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | APE1 bound to a nucleosome core particle with AP-site at SHL-6 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | nucleosome / DNA damage / DNA repair / DNA BINDING PROTEIN / DNA BINDING PROTEIN-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Resolution of Abasic Sites (AP sites) / class II DNA-(apurinic or apyrimidinic site) endonuclease activity / phosphodiesterase activity, acting on 3'-phosphoglycolate-terminated DNA strands / telomere maintenance via base-excision repair / site-specific endodeoxyribonuclease activity, specific for altered base / DNA-(abasic site) binding / double-stranded DNA exodeoxyribonuclease activity / double-stranded telomeric DNA binding / double-stranded DNA 3'-5' DNA exonuclease activity / phosphodiesterase I activity ...Resolution of Abasic Sites (AP sites) / class II DNA-(apurinic or apyrimidinic site) endonuclease activity / phosphodiesterase activity, acting on 3'-phosphoglycolate-terminated DNA strands / telomere maintenance via base-excision repair / site-specific endodeoxyribonuclease activity, specific for altered base / DNA-(abasic site) binding / double-stranded DNA exodeoxyribonuclease activity / double-stranded telomeric DNA binding / double-stranded DNA 3'-5' DNA exonuclease activity / phosphodiesterase I activity / exodeoxyribonuclease III / positive regulation of gene expression via chromosomal CpG island demethylation / Displacement of DNA glycosylase by APEX1 / phosphoric diester hydrolase activity / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ / uracil DNA N-glycosylase activity / DNA catabolic process / 3'-5'-DNA exonuclease activity / Resolution of AP sites via the multiple-nucleotide patch replacement pathway / Abasic sugar-phosphate removal via the single-nucleotide replacement pathway / POLB-Dependent Long Patch Base Excision Repair / PCNA-Dependent Long Patch Base Excision Repair / Replacement of protamines by nucleosomes in the male pronucleus / arachidonate 15-lipoxygenase / arachidonate 15-lipoxygenase activity / Packaging Of Telomere Ends / lipoxygenase pathway / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / arachidonate metabolic process / Chromatin modifying enzymes / lipid oxidation / Deposition of new CENPA-containing nucleosomes at the centromere / hepoxilin biosynthetic process / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / linoleic acid metabolic process / Meiotic synapsis / Inhibition of DNA recombination at telomere / nucleosomal DNA binding / DNA-(apurinic or apyrimidinic site) endonuclease activity / regulation of mRNA stability / RNA Polymerase I Promoter Opening / Assembly of the ORC complex at the origin of replication / 3'-5' exonuclease activity / telomere maintenance / Interleukin-7 signaling / DNA methylation / Condensation of Prophase Chromosomes / HCMV Late Events / SIRT1 negatively regulates rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / base-excision repair, gap-filling / PRC2 methylates histones and DNA / cell redox homeostasis / Defective pyroptosis / Meiotic recombination / innate immune response in mucosa / DNA Damage/Telomere Stress Induced Senescence / DNA endonuclease activity / HDACs deacetylate histones / Nonhomologous End-Joining (NHEJ) / RNA Polymerase I Promoter Escape / Transcriptional regulation by small RNAs / Transcriptional regulation of granulopoiesis / HDMs demethylate histones / Formation of the beta-catenin:TCF transactivating complex / HCMV Early Events / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / G2/M DNA damage checkpoint / NoRC negatively regulates rRNA expression / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / PKMTs methylate histone lysines / B-WICH complex positively regulates rRNA expression / base-excision repair / heterochromatin formation / chromatin DNA binding / RMTs methylate histone arginines / Pre-NOTCH Transcription and Translation / Metalloprotease DUBs / Activation of anterior HOX genes in hindbrain development during early embryogenesis / structural constituent of chromatin / transcription corepressor activity / UCH proteinases / nucleosome / antimicrobial humoral immune response mediated by antimicrobial peptide / RNA-DNA hybrid ribonuclease activity / Factors involved in megakaryocyte development and platelet production / Processing of DNA double-strand break ends / nucleosome assembly / Recruitment and ATM-mediated phosphorylation of repair and signaling proteins at DNA double strand breaks / chromatin organization / E3 ubiquitin ligases ubiquitinate target proteins / Senescence-Associated Secretory Phenotype (SASP) / RUNX1 regulates transcription of genes involved in differentiation of HSCs / HATs acetylate histones / antibacterial humoral response / chromosome, telomeric region / Oxidative Stress Induced Senescence 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Weaver TM / Freudenthal BD | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structural basis for APE1 processing DNA damage in the nucleosome. 著者: Tyler M Weaver / Nicole M Hoitsma / Jonah J Spencer / Lokesh Gakhar / Nicholas J Schnicker / Bret D Freudenthal /  要旨: Genomic DNA is continually exposed to endogenous and exogenous factors that promote DNA damage. Eukaryotic genomic DNA is packaged into nucleosomes, which present a barrier to accessing and ...Genomic DNA is continually exposed to endogenous and exogenous factors that promote DNA damage. Eukaryotic genomic DNA is packaged into nucleosomes, which present a barrier to accessing and effectively repairing DNA damage. The mechanisms by which DNA repair proteins overcome this barrier to repair DNA damage in the nucleosome and protect genomic stability is unknown. Here, we determine how the base excision repair (BER) endonuclease AP-endonuclease 1 (APE1) recognizes and cleaves DNA damage in the nucleosome. Kinetic assays determine that APE1 cleaves solvent-exposed AP sites in the nucleosome with 3 - 6 orders of magnitude higher efficiency than occluded AP sites. A cryo-electron microscopy structure of APE1 bound to a nucleosome containing a solvent-exposed AP site reveal that APE1 uses a DNA sculpting mechanism for AP site recognition, where APE1 bends the nucleosomal DNA to access the AP site. Notably, additional biochemical and structural characterization of occluded AP sites identify contacts between the nucleosomal DNA and histone octamer that prevent efficient processing of the AP site by APE1. These findings provide a rationale for the position-dependent activity of BER proteins in the nucleosome and suggests the ability of BER proteins to sculpt nucleosomal DNA drives efficient BER in chromatin. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
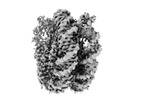
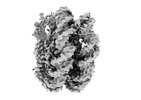
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_26336.map.gz emd_26336.map.gz | 1.2 GB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-26336-v30.xml emd-26336-v30.xml emd-26336.xml emd-26336.xml | 18.2 KB 18.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_26336.png emd_26336.png | 68.6 KB | ||
| Filedesc metadata |  emd-26336.cif.gz emd-26336.cif.gz | 6.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-26336 http://ftp.pdbj.org/pub/emdb/structures/EMD-26336 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26336 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26336 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_26336_validation.pdf.gz emd_26336_validation.pdf.gz | 504.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_26336_full_validation.pdf.gz emd_26336_full_validation.pdf.gz | 504 KB | 表示 | |
| XML形式データ |  emd_26336_validation.xml.gz emd_26336_validation.xml.gz | 9.5 KB | 表示 | |
| CIF形式データ |  emd_26336_validation.cif.gz emd_26336_validation.cif.gz | 10.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26336 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26336 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26336 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26336 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_26336.map.gz / 形式: CCP4 / 大きさ: 1.3 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_26336.map.gz / 形式: CCP4 / 大きさ: 1.3 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.40075 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : APE1 bound to a nucleosome core particle with AP-site at SHL-6
| 全体 | 名称: APE1 bound to a nucleosome core particle with AP-site at SHL-6 |
|---|---|
| 要素 |
|
-超分子 #1: APE1 bound to a nucleosome core particle with AP-site at SHL-6
| 超分子 | 名称: APE1 bound to a nucleosome core particle with AP-site at SHL-6 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#7 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Histone H3.2
| 分子 | 名称: Histone H3.2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 15.257838 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: ARTKQTARKS TGGKAPRKQL ATKAARKSAP ATGGVKKPHR YRPGTVALRE IRRYQKSTEL LIRKLPFQRL VREIAQDFKT DLRFQSSAV MALQEASEAY LVGLFEDTNL AAIHAKRVTI MPKDIQLARR IRGERA UniProtKB: Histone H3.2 |
-分子 #2: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.263231 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SGRGKGGKGL GKGGAKRHRK VLRDNIQGIT KPAIRRLARR GGVKRISGLI YEETRGVLKV FLENVIRDAV TYTEHAKRKT VTAMDVVYA LKRQGRTLYG FGG UniProtKB: Arachidonate 15-lipoxygenase |
-分子 #3: Histone H2A type 1
| 分子 | 名称: Histone H2A type 1 / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.990342 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SGRGKQGGKA RAKAKTRSSR AGLQFPVGRV HRLLRKGNYA ERVGAGAPVY LAAVLEYLTA EILELAGNAA RDNKKTRIIP RHLQLAIRN DEELNKLLGK VTIAQGGVLP NIQAVLLPKK TESHHKAKGK UniProtKB: Histone H2A type 1 |
-分子 #4: Histone H2B type 1-C/E/F/G/I
| 分子 | 名称: Histone H2B type 1-C/E/F/G/I / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.806018 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: PEPAKSAPAP KKGSKKAVTK AQKKDGKKRK RSRKESYSVY VYKVLKQVHP DTGISSKAMG IMNSFVNDIF ERIAGEASRL AHYNKRSTI TSREIQTAVR LLLPGELAKH AVSEGTKAVT KYTSSK UniProtKB: Histone H2B type 1-C/E/F/G/I |
-分子 #7: DNA-(apurinic or apyrimidinic site) endonuclease
| 分子 | 名称: DNA-(apurinic or apyrimidinic site) endonuclease / タイプ: protein_or_peptide / ID: 7 / コピー数: 1 / 光学異性体: LEVO EC番号: 加水分解酵素; エステル加水分解酵素 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 35.606492 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPKRGKKGAV AEDGDELRTE PEAKKSKTAA KKNDKEAAGE GPALYEDPPD QKTSPSGKPA TLKICSWNVD GLRAWIKKKG LDWVKEEAP DILCLQETKC SENKLPAELQ ELPGLSHQYW SAPSDKEGYS GVGLLSRQCP LKVSYGIGDE EHDQEGRVIV A EFDSFVLV ...文字列: MPKRGKKGAV AEDGDELRTE PEAKKSKTAA KKNDKEAAGE GPALYEDPPD QKTSPSGKPA TLKICSWNVD GLRAWIKKKG LDWVKEEAP DILCLQETKC SENKLPAELQ ELPGLSHQYW SAPSDKEGYS GVGLLSRQCP LKVSYGIGDE EHDQEGRVIV A EFDSFVLV TAYVPNAGRG LVRLEYRQRW DEAFRKFLKG LASRKPLVLC GDLNVAHEEI DLRNPKGNKK NAGFTPQERQ GF GELLQAV PLADSFRHLY PNTPYAYTFW TYMMNARSKN VGWRLDYFLL SHSLLPALCD SKIRSKALGS DHCPITLYLA L UniProtKB: DNA repair nuclease/redox regulator APEX1 |
-分子 #5: DNA (144-MER)
| 分子 | 名称: DNA (144-MER) / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 45.005656 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DG)(DA)(DG)(DA)(DA)(DT)(DC) (DC)(DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA) (DG)(DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA) (DA)(DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA) (DG) (DA)(DC)(DA)(DG)(DC) ...文字列: (DA)(DT)(DC)(DG)(DA)(DG)(DA)(DA)(DT)(DC) (DC)(DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA) (DG)(DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA) (DA)(DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA) (DG) (DA)(DC)(DA)(DG)(DC)(DT)(DC)(DT) (DA)(DG)(DC)(DA)(DC)(DC)(DG)(DC)(DT)(DT) (DA)(DA) (DA)(DC)(DG)(DC)(DA)(DC)(DG) (DT)(DA)(DC)(DG)(DC)(DG)(DC)(DT)(DG)(DT) (DC)(DC)(DC) (DC)(DC)(DG)(DC)(DG)(DT) (DT)(DT)(DT)(DA)(DA)(DC)(DC)(DG)(DC)(DC) (DA)(DA)(DG)(DG) (DG)(DG)(DA)(DT)(DT) (DA)(DC)(DT)(DC)(DC)(DC)(DT)(DA)(DG)(DT) (DC)(DT)(DC)(DC)(DA) (DG)(DG)(DC)(DA) (DC)(DG)(DT)(DG)(DT)(DC)(DA)(DG)(DA)(DT) (DA)(DT)(DA)(DT)(3DR) (DC)(DA)(DT)(DC) (DC)(DG)(DA)(DT) |
-分子 #6: DNA (145-MER)
| 分子 | 名称: DNA (145-MER) / タイプ: dna / ID: 6 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 45.610043 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DG)(DG)(DA)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC) (DA)(DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG) (DG)(DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG) (DA) (DG)(DT)(DA)(DA)(DT) ...文字列: (DA)(DT)(DC)(DG)(DG)(DA)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC) (DA)(DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG) (DG)(DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG) (DA) (DG)(DT)(DA)(DA)(DT)(DC)(DC)(DC) (DC)(DT)(DT)(DG)(DG)(DC)(DG)(DG)(DT)(DT) (DA)(DA) (DA)(DA)(DC)(DG)(DC)(DG)(DG) (DG)(DG)(DG)(DA)(DC)(DA)(DG)(DC)(DG)(DC) (DG)(DT)(DA) (DC)(DG)(DT)(DG)(DC)(DG) (DT)(DT)(DT)(DA)(DA)(DG)(DC)(DG)(DG)(DT) (DG)(DC)(DT)(DA) (DG)(DA)(DG)(DC)(DT) (DG)(DT)(DC)(DT)(DA)(DC)(DG)(DA)(DC)(DC) (DA)(DA)(DT)(DT)(DG) (DA)(DG)(DC)(DG) (DG)(DC)(DC)(DT)(DC)(DG)(DG)(DC)(DA)(DC) (DC)(DG)(DG)(DG)(DA)(DT) (DT)(DC)(DT) (DC)(DG)(DA)(DT) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. | ||||||||||
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 58854 |
| 初期 角度割当 | タイプ: RANDOM ASSIGNMENT / ソフトウェア - 名称: cryoSPARC / 詳細: Ab-initio |
| 最終 角度割当 | タイプ: OTHER / ソフトウェア - 名称: cryoSPARC |
 ムービー
ムービー コントローラー
コントローラー